��Ŀ����
����Ŀ����ҵ�ϻ�������ij�Ͻ���ϣ���Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe��Ϊ�еȻ��ý������Ĺ���������ͼ��  �ش��������⣺
�ش��������⣺
��1����NH4��2C2O4��C�Ļ��ϼ�Ϊ ��
��2���Ͻ���ϼ��������ȡ��������ܻ�Ϊ���ᣬԭ���� �� ����M ����Ҫ�ɷ���һ�ֽ������ʣ��ý���Ϊ ��
��3��������Һ�����Ⱥ����������Լ��漰��ˮ��H2O2��Һ��Ӧ�ȼ��� �� ���백ˮ������Ӧ�����ӷ���ʽΪ ��
��4����ҺA�еĽ����������� �� ���루NH4��2C2O4��Һ��Ŀ���� ��
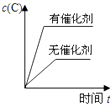
��5��������l���������� �� �����ܸ��±�������Co2O3 �� ʵ�����и��±���ʹ�õ�������������ĸ���� a�������� b�������� c���ձ� d������
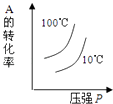
��6����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ�����������2���У�����Ũ��������ȹ��ˣ���Ŀ���� �� 90��ʱKsp��Li2CO3����ֵΪ ��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
���𰸡�
��1��+3
��2�������ܽ����ʱ�������ж����壬��CuҲ�ܽ��������У�Cu
��3��H2O2��Һ��Fe3++3NH3?H2O=Fe��OH��3��+3NH4+
��4��Co2+��Li+��ʹCo2+ת��Ϊ�����ܳ���
��5�����ˣ�d
��6������Li2CO3���ܽ���ʧ��4.0��10��3
���������⣺��1�����ݻ��ϼ۴�����Ϊ0���� NH4��2C2O4��C�Ļ��ϼ�Ϊ+3�����Դ��ǣ�+3����2����Ϊ�����ܽ����ʱ�������ж����壬��CuҲ�ܽ��������У���������ܻ�Ϊ���ᣬ���������жϽ���MΪCu�����Դ��ǣ������ܽ����ʱ�������ж����壬��CuҲ�ܽ��������У�Cu����3������H2O2��������������������Ϊ�����ӣ����백ˮ�������ǵ�����ҺPHʹFe3+ת��ΪFe��OH��3���������ӷ���ʽΪ��Fe3++3NH3H2O=Fe��OH��3��+3NH4+ �� ����Ӧ�ȼ���H2O2��Һ�����Դ��ǣ�H2O2��Һ��Fe3++3NH3H2O=Fe��OH��3��+3NH4+����4���������Ϸ�������ҺA�еĽ�����������Co2+��Li+ �� ���루NH4��2C2O4��Һ��Ŀ����ʹCo2+ת��Ϊ�����ܳ��������Դ��ǣ�Co2+��Li+��ʹCo2+ת��Ϊ�����ܳ�������5���������Ϸ�����������l���������ǹ��ˣ������ܸ��±�������Co2O3 �� ʵ�����и��±���ʹ�õ�������������
���Դ��ǣ����ˣ�d����6��Li2CO3����ˮ���ܽ�����¶����߶����ͣ�Ϊ����Li2CO3���ܽ���ʧ������Ũ���������ȹ��ˣ�90��ʱc��Li2CO3����Ũ��Ϊ0.10mol/L����c��Li+��=0.20mol/L��c��CO32����=0.10mol/L����Ksp��Li2CO3��=0.20��0.20��0.10=4.0��10��3 ��
���Դ��ǣ�����Li2CO3���ܽ���ʧ��4.0��10��3 ��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д� ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�