题目内容
下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
A.SO2+H2O H2SO3 H2SO3 |
| B.Cl2+H2O=HCl+HClO |
C.3Fe+4H2O(g) Fe2O4+4H2 Fe2O4+4H2 |
| D.2Na+2H2O=2NaOH+H2↑ |
B
解析试题分析:A.SO2+H2O H2SO3 该反应是可逆反应,但是由于元素的化合价未发生变化,所以不是氧化还原反应。错误。 B.Cl2+H2O=HCl+HclO有元素的化合价的变化,是氧化还原反应。但是只有Cl元素的化合价的升高与降低。所以水既不是氧化剂也不是还原剂。正确。C.3Fe+4H2O(g)
H2SO3 该反应是可逆反应,但是由于元素的化合价未发生变化,所以不是氧化还原反应。错误。 B.Cl2+H2O=HCl+HclO有元素的化合价的变化,是氧化还原反应。但是只有Cl元素的化合价的升高与降低。所以水既不是氧化剂也不是还原剂。正确。C.3Fe+4H2O(g) Fe2O4+4H2。在该反应中水中的H元素的化合价降低,得到电子,所以水作氧化剂。错误。D.2Na+2H2O=2NaOH+H2↑在该反应中水中的H元素的化合价降低,得到电子,所以水作氧化剂。错误。
Fe2O4+4H2。在该反应中水中的H元素的化合价降低,得到电子,所以水作氧化剂。错误。D.2Na+2H2O=2NaOH+H2↑在该反应中水中的H元素的化合价降低,得到电子,所以水作氧化剂。错误。
考点:考查在化学反应中水的作用的知识。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案根据表中信息判断,下列选项正确的是( )
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 |
| C.第③组反应中生成1mol Cl2,转移电子5mol |
| D.氧化性由强到弱顺序为MnO4 >Cl2> Fe3+> Br2 |
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是
| A.a原子的最外层电子数比b原子的最外层电子数少 |
| B.把a、b两块金属片浸入稀硫酸中,用导线相连组成原电池时,电流由 a到b |
| C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多 |
| D.常温时,a能从水中置换出氢,而b不能 |
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是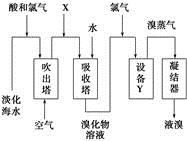
| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下) |
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
| A.(a+3b) mol |
B.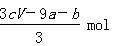 |
C.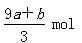 |
| D.(cV-3a-9b) mol |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。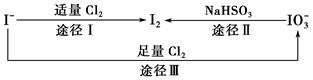
| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )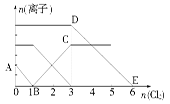
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6 mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |