题目内容
海洋是一座巨大的宝藏,海水中蕴含80多种元素.氯碱工业和金属镁的制备原料都来自于海水.Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示).
(1)写出两电极的反应式:阳极
(2)石棉隔膜的作用是
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高.20世纪80年代起,隔膜法电解工艺逐渐被离子膜电解技术取代.
(1)离子膜电解槽(如图乙所示)中⑥、⑦分别是
(2)已知一个电子的电量是1.602×10-19C,在离子膜电解饱和食盐水时电路中通过电子1.929×105C,则产生NaOH
Ⅲ.如图丙是工业上生产镁的流程.
(1)写出下列反应的化学方程式:
①沉淀池中:
②电解:
(2)整个生产流程中,循环使用的物质是
(3)简述加热氯化镁的水合晶体使之脱水转化为无水氯化镁的操作过程:
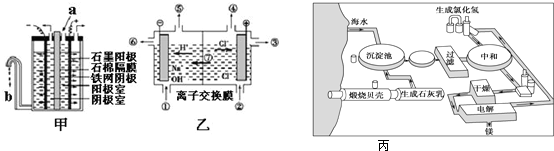
分析:Ⅰ.(1)用惰性电极电解氯化钠溶液,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气;
(2)Cl2和NaOH反应生成氯化钠、次氯酸钠和水,石棉隔膜的作用阻止气体通过;
Ⅱ.(1)离子膜电解槽只允许阳离子和水分子通过;⑥为氢氧化钠,⑦为钠离子;
(2)依据电极反应和电子守恒分析计算得到;
Ⅲ.(1)①在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,得到氢氧化镁沉淀,发生复分解反应;
②电解熔融氯化镁,为氧化还原反应,生成镁和氯气;
(2)根据流程图可以看出,氯气可以循环利用;
(3)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解.
(2)Cl2和NaOH反应生成氯化钠、次氯酸钠和水,石棉隔膜的作用阻止气体通过;
Ⅱ.(1)离子膜电解槽只允许阳离子和水分子通过;⑥为氢氧化钠,⑦为钠离子;
(2)依据电极反应和电子守恒分析计算得到;
Ⅲ.(1)①在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,得到氢氧化镁沉淀,发生复分解反应;
②电解熔融氯化镁,为氧化还原反应,生成镁和氯气;
(2)根据流程图可以看出,氯气可以循环利用;
(3)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解.
解答:解:Ⅰ.(1)用惰性电极电解饱和食盐时,阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,发生的方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生的方程式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,防止Cl2和NaOH反应,石棉隔膜的作用是阻止气体通过,
故答案为:阻止气体通过;
Ⅱ.(1)电解饱和食盐水,电解槽离子膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+,
故答案为:NaOH溶液;Na+;
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,电子数=
=1.204×1024,
=2mol,电子物质的量为2mol,阴极电极反应为:2H++2e-=H2↑,依据化学方程式和电子守恒分析计算2NaCl+2H2O
2NaOH+H2↑+Cl2↑,转移电子2mol生成氢氧化钠2mol,质量为80g,
故答案为:80;
Ⅲ.(1)①把海水中的氯化镁转化成氢氧化镁沉淀,是往海水中加熟石灰,氯化镁和石灰乳的成分氢氧化钙反应MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,由于氢氧化镁不溶于水,因此可以采用过滤的方法使沉淀分离出来,因石灰乳是悬浊物,所以氢氧化镁沉淀无需标沉淀,
故答案为:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2;
②无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)
Mg+Cl2↑,
故答案为:MgCl2(熔融)
Mg+Cl2↑;
(2)根据流程图可以看出,氯气可以循环利用,故答案为:氯气(或Cl2);
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,得到无水MgCl2,
故答案为:为了防止氯化镁水解,要在氯化氢气体的氛围中进行加热.
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,防止Cl2和NaOH反应,石棉隔膜的作用是阻止气体通过,
故答案为:阻止气体通过;
Ⅱ.(1)电解饱和食盐水,电解槽离子膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+,
故答案为:NaOH溶液;Na+;
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,电子数=
| 1.929×105C |
| 1.602×10-19C |
| 1.204×1024 |
| 6.02×1023 |
| ||
故答案为:80;
Ⅲ.(1)①把海水中的氯化镁转化成氢氧化镁沉淀,是往海水中加熟石灰,氯化镁和石灰乳的成分氢氧化钙反应MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,由于氢氧化镁不溶于水,因此可以采用过滤的方法使沉淀分离出来,因石灰乳是悬浊物,所以氢氧化镁沉淀无需标沉淀,
故答案为:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2;
②无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)
| ||
故答案为:MgCl2(熔融)
| ||
(2)根据流程图可以看出,氯气可以循环利用,故答案为:氯气(或Cl2);
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,得到无水MgCl2,
故答案为:为了防止氯化镁水解,要在氯化氢气体的氛围中进行加热.
点评:本题主要考查了氯碱工业和金属镁的制备,掌握电解饱和食盐水的反应原理和海水中镁的提取方法是解答的关键,题目难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
【化学--化学与技术】
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1.其中阴 (阳)离子交换膜只允许阴(阳)离子通过.
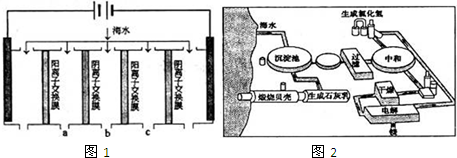
①阴极的电极反应式为 .
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式 .
③淡水的出口为a、b、c中的 出口.
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是 .
②整个生产流程中,循环使用的物质是 .
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是 (填“同意”或“不同意”);理由是 .
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是
②整个生产流程中,循环使用的物质是
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是
 (2011?宁波模拟)“化学与技术”模块
(2011?宁波模拟)“化学与技术”模块

