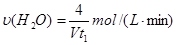题目内容
一定条件下反应2AB(g) 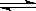 A2(g)+B2(g)达到平衡状态的标志是 ( )
A2(g)+B2(g)达到平衡状态的标志是 ( )
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.容器的总压强不变
D.容器中各组分的体积分数不随时间变化
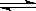 A2(g)+B2(g)达到平衡状态的标志是 ( )
A2(g)+B2(g)达到平衡状态的标志是 ( )A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.容器的总压强不变
D.容器中各组分的体积分数不随时间变化
D
试题分析:反应2AB(g)
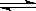 A2(g)+B2(g),反应前后压强不随时间的变化而变化;所以B,C都错;而单位时间内生成nmolA2,同时消耗2n molAB都表示的是正反应速率;故选D。
A2(g)+B2(g),反应前后压强不随时间的变化而变化;所以B,C都错;而单位时间内生成nmolA2,同时消耗2n molAB都表示的是正反应速率;故选D。点评:判定一化学平衡状态的一般标志
化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)2pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解。
1.一等
“一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质。若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比。在试题中可有以下几种具体形式出现:
⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成)。
⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗):υB(生成) =m:n,或υC(消耗):υD(生成) =p:q。
⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗) =m:p,或υB(生成):υD(生成) = n:q。
⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
2.五不变
“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q时,混合气体总物质的量不变。
在试题中可有以下几种具体形式出现:
⑴各组分的物质的量不变,如一定温度的密闭容器中,A、B、C、D的分子数不再改变。
⑵各组分的浓度不变,如外界条件不变时,对于有颜色的物质参加或生成的可逆反应,混合气体的颜色不随时间发生变化。
⑶各组分的百分含量不变,如各组分的体积分数、物质的量分数、质量分数保持不变。
⑷反应物的转化率不变,如在一定条件下,A或B的转化率不再改变。
以上各项既适用于反应前后气体化学计量数之和不相等的可逆反应,又适用反应前后气体化学计量数之和相等的可逆反应。
⑸对于全为气体参加的前后化学计量数改变的可逆反应,混合气体总物质的量不变。如当m+n╪p+q时,恒温恒容时,体系的总压强不发生变化;当m+n╪p+q时,恒温恒压时,体系的总体积不发生变化;当m+n╪p+q时,恒容时混合气体的平均相对分子质量不发生变化。
二化学平衡状态的特殊标志
在恒容条件下,混合气体的密度能否作为化学平衡状态的标志呢?这主要看可逆反应中有无非气态物质参加或生成。因为该条件下的气体密度只和气体的质量有关,若是全气态物质参加的可逆反应,在恒容条件下,不论是否达到平衡,混合气体的总质量都不发生变化,混合气体的密度不发生变化,此时不能作为化学平衡状态的判断标志。若有非气态物质参与的可逆反应,在恒容条件下,只有达到平衡时,混合气体的总质量才不会发生变化,混合气体的密度不会发生变化,此时密度才能作为化学平衡状态的判断标志。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2Z(g)达到限度的标志是
2Z(g)达到限度的标志是  C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是  pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )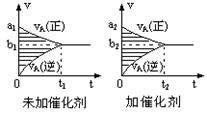
 U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )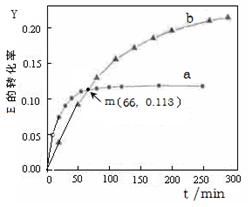
 2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为
2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol