题目内容
6.100mL6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的( )| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | CH3COONa(固体) |
分析 反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.碳酸钠与酸反应,生成氢气的量减少,故A选;
B.加入水,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故B不选;
C.加适量的硫酸钾溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故C不选;
D.加适量的醋酸钠,会和硫酸反应生成醋酸,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故D不选.
故选A.
点评 本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,选项D为学生解答中的难点,注意醋酸为弱酸的特点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.实验室进行蒸馏和蒸发实验时,都要用到的仪器是( )
| A. | 温度计 | B. | 冷凝管 | C. | 玻璃棒 | D. | 酒精灯 |
14.下列混合物适用过滤法分离的是( )
| A. | KCl、NaNO3 | B. | 水、酒精 | C. | Na2CO3、CaCO3 | D. | MgSO4、ZnSO4 |
11.现有NO、NO2、O3三种气体,它们都含有1mol氧原子,则三种气体的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
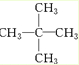 ,名称为2,2-二甲基丙烷(新戊烷).
,名称为2,2-二甲基丙烷(新戊烷).
 (1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;
(1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;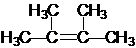 ;
;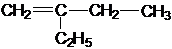 .
.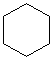 .
.