题目内容
19.碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜玛拉雅山区是高发病地区.我国云南、河南等十余个省的山区的发病率也较高.为控制该病的发生,较为有效的方法是加碘食盐.我国政府以国家标准的方式规定在食盐中添加碘酸钾.据此回答下面问题.(1)碘是合成下列哪种激素的主要原料之一B
A 胰岛素 B 甲状腺激素 C 生长激素 D 糖尿病
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患C
A 甲状腺机能亢进 B 佝偻病
C 地方性甲状腺肿 D 雄性激素减少
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾.反应的化学方程式为:5KI+KIO3+6HCl═6KCl+3I2+3H2O.此反应的氧化剂是KIO3(填化学式),能观察到的明显现象是溶液变蓝.
分析 (1)碘是合成甲状腺激素的主要元素;
(2)根据碘的生理功能,以及甲状腺机能亢进、佝偻病、地方性甲状腺肿的成因判断;
(3)根据氧化还原反应中氧化剂和还原剂的概念以及碘单质遇淀粉试液变蓝色来回答.
解答 解:(1)人体摄入的碘主要是来自海产品和碘盐,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,故选B;
(2)A.甲状腺机能亢进是因碘摄入太多造成的,故A错误;
B.钙主要存在于骨胳和牙齿中,使骨和牙齿具有坚硬的结构支架,缺乏幼儿和青少年会患佝偻病,老年人会患骨质疏松,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,故B错误;
C.碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大,故C正确;
D.雄性激素减少与碘缺乏无关,故D错误.
故选C;
(3)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;该反应中KI是还原剂,KIO3是氧化剂,碘遇淀粉试液变蓝色,所以反应现象为:溶液由无色变蓝色,故答案为:KIO3;溶液变蓝色.
点评 本题考查了碘及其化合物的性质应以及氧化还原反应的概念知识,特别要注意氧化还原反应中氧化产物和还原产物是同一物质的化学反应,难度不大.

练习册系列答案
相关题目
10.现有A、B两种有机物,无论以何种比例混合,只要混合物总质量一定,完全燃烧后,生成的H2O的质量也一定.下列结论正确的是( )
| A. | A、B中的氢的质量分数必相等 | |
| B. | A、B的实验式必相同 | |
| C. | A、B一定是同系物 | |
| D. | A、B可以是烃,也可以是烃的含氧衍生物 |
7.某溶液中含有0.005mol FeBr2及其他物质,向该溶液中通入134.4mL(标准状况)Cl2,溶液中只有FeBr2与Cl2反应,则通入Cl2后溶液中可能大量存在的离子是( )
| A. | Fe2+、Fe3+、Br-、NO3- | B. | Fe2+、H+、NO3-、K+ | ||
| C. | Fe3+、Br-、NO3-、Cl- | D. | Fe2+、Br-、NO3-、Cl- |
4.鉴别①硫酸镁②氢氧化钠③硫酸铜④氯化钾四种溶液,可用先被鉴别出来的物质来鉴别剩余溶液,则被鉴别出来的物质顺序正确的是( )
| A. | ①②③④ | B. | ③①②④ | C. | ④③②① | D. | ③②①④ |
3.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,其他条件不变时,若改变影响平衡的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是:( )


| A. | 30min时降低温度,40min时升高温度 | |
| B. | 前8min A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
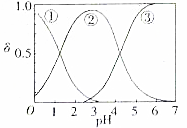 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.