题目内容
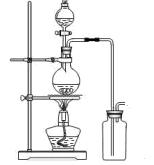
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
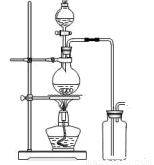
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3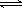 H++HCO3-
Ka1 =4.45×10-7
H++HCO3-
Ka1 =4.45×10-7
HCO3-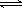 H++CO32-
Ka2=5.61×10-11
H++CO32-
Ka2=5.61×10-11
HClO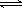 H++ClO-
Ka=2.95×10-8
H++ClO-
Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
(1)MnO2+2Cl-+4H+====Mn2++Cl2↑+2H2O
控制浓盐酸的流量和流速,使其慢慢滴入,防止过量的浓盐酸挥发出HCl气体
饱和食盐水
(2)浓盐酸的浓度随着反应的进行而降低,变稀以后,将不再反应,并且加热时浓盐酸因挥发而损失
(3)Cl2+2CO32-+ H2O=2HCO3-+Cl-+ClO-
(4)E NaOH溶液 吸收氯气防止污染空气
【解析】

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验 ,制取氯气的装置如图I和Ⅱ。
,制取氯气的装置如图I和Ⅱ。
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 | ① 。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 | 验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 | 使红色布条褪色的物质是 。 |
某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,制取氯气的装置如图I和Ⅱ。
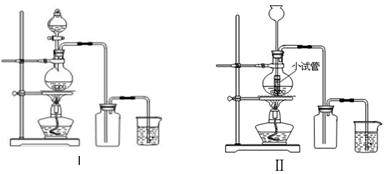
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 | ① 。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 | 验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 | 使红色布条褪色的物质是 。 |
 H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7