题目内容
(8分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)NO的平衡浓度c(NO)= 。
(2)用O2表示从0~2s内该反应的平均反应速率v= 。
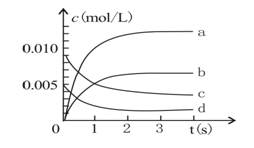
(3)下图中表示NO2变化的曲线是
(4)800℃时,容器内起始压强和平衡后压强之比为___________________
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均反应速率v= 。
(3)下图中表示NO2变化的曲线是

(4)800℃时,容器内起始压强和平衡后压强之比为___________________
(8分)⑴3.5×10-3mol·L-1 (2)1.5×10-3mol·L-1·s-1(3)b (4) 3 : 2.35
(1)3s时,NO的量不再改变,说明达到平衡状态;
(2)v(NO)= =0.003mol·L-1,则v(O2)=0.0015mol·L-1
=0.003mol·L-1,则v(O2)=0.0015mol·L-1
(3)由题设条件可知平衡时△n(NO)=0.013mol,生成NO2为0.013mol,则其c(NO)=0.0065mol·L-1,结合图像可知NO2变化的曲线为b线
(4)2NO + O2 2NO2
2NO2
始n:0.02 0.01 0
△n:0.013 0.0065 0.013
平n:0.007 0.0035 0.013
在恒容情况下,气体的物质的量比等于压强比,则起始压强和平衡后压强之比为 3 : 2.35
(2)v(NO)=
 =0.003mol·L-1,则v(O2)=0.0015mol·L-1
=0.003mol·L-1,则v(O2)=0.0015mol·L-1(3)由题设条件可知平衡时△n(NO)=0.013mol,生成NO2为0.013mol,则其c(NO)=0.0065mol·L-1,结合图像可知NO2变化的曲线为b线
(4)2NO + O2
 2NO2
2NO2始n:0.02 0.01 0
△n:0.013 0.0065 0.013
平n:0.007 0.0035 0.013
在恒容情况下,气体的物质的量比等于压强比,则起始压强和平衡后压强之比为 3 : 2.35

练习册系列答案
相关题目
 2NH3中,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为O.45 mol/(L·s),则反应所经历的时间为
2NH3中,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为O.45 mol/(L·s),则反应所经历的时间为 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,则:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,则: 4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为
4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为