题目内容
【题目】热化学和各类平衡等都是化学研究的对象
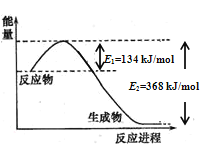
(1)已知:①2O2(g)+N2(g)=N2O4(l) ΔH1;
②N2(g)+2H2(g)=N2H4(g) ΔH2;
③O2(g)+2H2(g)=2H2O(g) ΔH3;
④2N2H4(g)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4 =___________(用含ΔH1、ΔH2、ΔH3的代数式表示)
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 0.6 | 3 |
3 | 900 | a | b | c | d | t |
① 该反应为________(填“吸热”或“放热”)反应;实验2的平衡常数K= _________。
② 若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4mol H2O(g),使反应达到新平衡,下列说法不正确的是_______。
A.新旧平衡时容器气体压强之比为5:3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-1
D.新旧平衡时容器气体密度之比为5:3
(3)室温下,用0.1 mol·L-1的KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
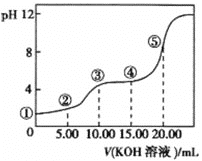
①点②所示的溶液中的电荷守恒式为_____________。
②点③所示溶液中各离子浓度由大到小的顺序为___________。
③点④所示溶液中c(K+) + c(H2C2O4 ) + c(![]() ) + c(
) + c(![]() ) =_______ mol·L-1。
) =_______ mol·L-1。
【答案】2ΔH3-ΔH1-2ΔH2 吸热 0.17(或![]() ) b=2a且a>1 BD c(K+)+c(H+)=c(OH-)+c(
) b=2a且a>1 BD c(K+)+c(H+)=c(OH-)+c(![]() )+2c(
)+2c(![]() ) c(K+)>c(
) c(K+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )>c(OH-) 0.10
)>c(OH-) 0.10
【解析】
:(1)结合盖斯定律分析作答;
(2)根据利用三段式计算化学平衡常数,结合影响因素作答;结合等效平衡的思想分析;
(3)根据酸碱中和滴定的原理与实质,分析每个过程反应后的溶质,根据水溶液的溶解平衡,结合盐类的三大守恒思想分析与计算离子浓度大小。
(1)本题考查热化学反应方程式的计算,根据盖斯定律,应是2×③-②×2-①得出△H4=2△H3-2△H2-△H1;
(2)①
实验1组 
根据平衡常数的表达式K=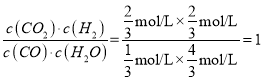 ,同理实验2的化学平衡常数为
,同理实验2的化学平衡常数为![]() ,升高温度平衡向逆反应方向移动,即逆反应方向是吸热反应;
,升高温度平衡向逆反应方向移动,即逆反应方向是吸热反应;
②考查等效平衡,两组实验达到平衡,组分的体积分数相等,说明两个平衡是等效平衡,即![]() ,得出b=2a;实验3达到平衡所用时间比实验2少,说明实验3反应速率快,反应物物质的量比实验2大,即a>1,综上所述,b=2a,且a>1;
,得出b=2a;实验3达到平衡所用时间比实验2少,说明实验3反应速率快,反应物物质的量比实验2大,即a>1,综上所述,b=2a,且a>1;
③再通入4mol水蒸气时,设生成二氧化碳x mol·L-1,则
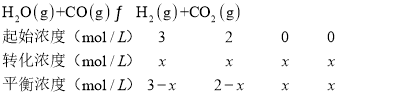
温度不变,则化学平衡常数不变,则有K=![]() =1,解得x=1.2,
=1,解得x=1.2,
A.压强之比等于物质的量之比,旧平衡物质的量为![]() ×2mol=6mol,新平衡物质的量为(1.8+0.8+1.2+1.2)×2mol=10,新平衡与旧平衡的压强之比为10:6=5:3,故A说法正确;
×2mol=6mol,新平衡物质的量为(1.8+0.8+1.2+1.2)×2mol=10,新平衡与旧平衡的压强之比为10:6=5:3,故A说法正确;
B.旧平衡H2O的转化率为2/3,新平衡H2O的转化率为0.4,因此新平衡H2O的转化率降低,故B说法错误;
C.新平衡时CO的浓度为0.8mol·L-1,故C说法正确;
D.两个平衡容器的容积相同,即密度之比等于气体质量之比,新平衡的密度与旧平衡的密度之比为(3×18+2×28)×2 :(1×18+2×28)×2 =110:74 ≠5:3,故D说法错误;
答案选BD;
(3)①因为草酸是二元弱酸,当加入10mLKOH时,溶液中的溶质为KHC2O4,因此点②时,溶液中的溶质为NaHC2O4和H2C2O4,电荷守恒:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-);
②根据a的分析,此时溶液中溶质为KHC2O4,③时溶液显酸性,说明HC2O4-的电离程度大于其水解程度,即离子浓度大小关系是c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
③当加入20mLKOH时,溶液中的溶质为K2C2O4,因此④点时的溶质为KHC2O4和K2C2O4,根据物料守恒:c(H2C2O4)+c(![]() )+c(
)+c(![]() )=10×10-3×
)=10×10-3×![]() ×103mol·L-1=0.04mol·L-1,c(K+)=15×10-3×
×103mol·L-1=0.04mol·L-1,c(K+)=15×10-3×![]() ×103mol·L-1=0.06mol·L-1,c(K+) +c(H2C2O4) +c(
×103mol·L-1=0.06mol·L-1,c(K+) +c(H2C2O4) +c(![]() ) + c(
) + c(![]() ) =0.1mol·L-1。
) =0.1mol·L-1。