题目内容
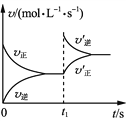
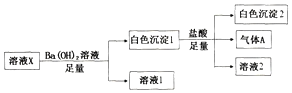
【题目】某溶液X中可能含有Na+、Fe3+、Mg2+、HCO3-、Cl-、SO42-、SO32-中的若干种,所含离子的物质的量浓度均相同,为了确定该溶液的组成,某同学取100mL上述溶液X,进行如下实验:
![]()
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在Na+、Mg2+、HCO3-、SO42-
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在-Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
【答案】B
【解析】
向溶液X中加入足量氢氧化钡溶液生成白色沉淀,说明溶液中一定不存在Fe3+,向白色沉淀中加入足量盐酸,沉淀部分溶解,并有气体生成,则溶液中一定有SO42-,可能有HCO3-或SO32-,因所含离子的物质的量浓度均相同,由电荷守恒可知,溶液中一定有Na+、Mg2+和HCO3-,一定没有SO32-、Cl-,综上可知溶液X中一定存在Na+、Mg2+、HCO3-、SO42-,一定不存在Fe3+、SO32-和Cl-。
A项、白色沉淀1为硫酸钡、碳酸钡和氢氧化镁,气体A为CO2,故A错误;
B项、由上述分析可知,溶液X中一定存在SO42-、HCO3-、Na+、Mg2+,故B正确;
C项、溶液X中一定不存在Fe3+,一定存在Mg2+、Na+,故C错误;
D项、溶液1中含Na+及过量的Ba(OH)2,溶液2含Mg2+、Ba2+、Cl-及过量盐酸,只有溶液2中加入硝酸酸化的硝酸银溶液能生成白色沉淀AgCl,故D错误;
故选B。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
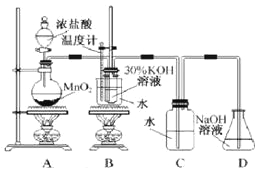
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
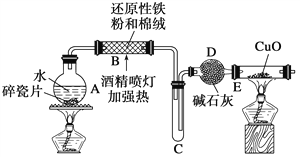
(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。