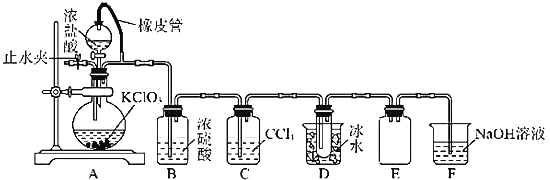
题目内容
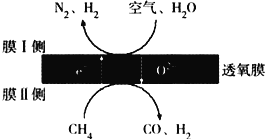
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
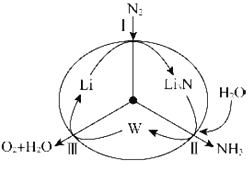
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
【答案】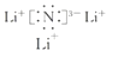
![]()
![]()
【解析】
(1) 根据![]() 是离子化合物写电子式;
是离子化合物写电子式;
(2)结合LiH与水的反应写![]() 和水反应的方程式;
和水反应的方程式;
(3)根据实验室制取氨气反应原理书写反应方程式。
(1) ![]() 是离子化合物,所以
是离子化合物,所以![]() 的电子式为
的电子式为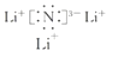 ,故答案为:
,故答案为: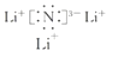 ;
;
(2)由过程Ⅱ可知,反应物为![]() 和水,即
和水,即![]() 和水反应生成氢氧化锂,放出氨气,其反应的化学方程式为:
和水反应生成氢氧化锂,放出氨气,其反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)实验室用熟石灰和氯化铵反应制氨气,制取氨气的化学反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3
CaCl2+2NH3![]() +2H2O,故答案为:2NH4Cl+Ca(OH)2
+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3
CaCl2+2NH3![]() +2H2O。
+2H2O。

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大