题目内容
【题目】下列叙述正确的是![]()
A.明矾和漂白粉常用于自来水净化和杀菌消毒,其作用原理相同
B.![]() 和
和![]() 的漂白原理不同,混合使用效果更好
的漂白原理不同,混合使用效果更好
C.汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾
D.可用浓盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性
【答案】C
【解析】
A.明矾中铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物而净水,漂白粉中含有次氯酸钠,次氯酸钠水解生成的次氯酸能将病毒氧化而杀菌消毒,所以二者原理不同,故A错误;
B.![]() ,盐酸和硫酸都没有漂白性,所以二者以1:1混合通入水中失去漂白性,故B错误;
,盐酸和硫酸都没有漂白性,所以二者以1:1混合通入水中失去漂白性,故B错误;
C.氮氧化物是形成酸雨和光化学烟雾的成分,汽车尾气中含有氮氧化物,所以汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾,故C正确;
D.浓盐酸、双氧水都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以无法判断过氧化氢具有还原性,故D错误;
答案:C。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物![]() 如图所示
如图所示![]() ,发生反应:
,发生反应:![]() 保持温度不变,测得平衡时的有关数据如下:
保持温度不变,测得平衡时的有关数据如下:

恒容容器甲 | 恒压容器乙 | |
Y的物质的量 |
|
|
Z的体积分数 |
|
|
下列说法正确的是![]()
A.平衡时容器乙的容积一定比反应前小
B.![]()
C.![]()
D.平衡时容器甲的压强一定比反应前大
【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式_____________________________________。
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
浓度(molL-1) | 时间(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
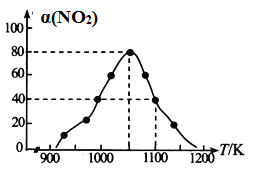
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(只列出计算式)(已知:气体分压=气体总压×体积分数)。