题目内容
【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备制备氯气,化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O。并对氯气的性质进行探究。
(1)氯气制备:

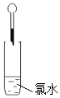
①欲收集一瓶干燥的氯气,请按接口序号完成“制取→收集”的连接顺序为:
→ c → d → → → i → j → k
②制备氯气也可用高锰酸钾固体和浓盐酸在常温下制得,其化学方程式为:
□KMnO4 + □HCl(浓) → □MnCl2 + □Cl2↑ + □KCl + □
请配平上述化学方程式。
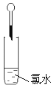
③请写出仪器G中可能反应的离子方程式为
(2)性质检验:将氯气溶于水后,进行实验检测。所用试剂有:0.01mol/LAgNO3溶液、紫色石蕊试液。
操作步骤 | 实验现象 | 解释原因 |
① | 滴加 ,现象有: | 原因有: |
② | 滴加 ,现象有: | 原因有: |
【答案】(1)①b、g、h ②2 16 2 5 2 8 H2O ③Cl2+2OH-=Cl-+ClO-+H2O
(2)
操作步骤 | 实验现象 | 解释原因 |
① | 滴加 AgNO3,现象有:产生白色沉淀 | 原因有:氯气与水反应后,电离出Cl-,Cl-与Ag+生成AgCl白色沉淀 (或Ag++Cl-=AgCl↓ ) |
② | 滴加 紫色石蕊试液,现象有: 先变红,后褪色 | 原因有: 氯气与水反应后,溶液显酸性使紫色石蕊试液变红,产生的HClO又使红色的石蕊试液发生漂白 (或其他合理答案) |
【解析】
试题分析:(1)氯气制备:固液加热型制备氯气,选择B装置;氯气中含有氯化氢、水等杂质,需要用饱和食盐水除去氯化氢、用浓硫酸除水,①欲收集一瓶干燥的氯气,请按接口序号完成“制取→收集”的连接顺序为:b→ c → d →g→h→ i → j → k
②制备氯气也可用高锰酸钾固体和浓盐酸在常温下制得,根据化合价升降配平化学方程式为:2 KMnO4 + 16HCl(浓) = 2MnCl2 + 5Cl2↑ + 2KCl + 8H20
③仪器G盛氢氧化钠溶液,用于氯气的尾气处理,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
(3)性质检验:将氯气溶于水后,进行实验检测。所用试剂有:0.01mol/LAgNO3溶液、紫色石蕊试液。
操作步骤 | 实验现象 | 解释原因 |
① | 滴加 AgNO3,现象有: 产生白色沉淀 | 原因有: 氯气与水反应后,电离出Cl-,Cl-与Ag+生成AgCl白色沉淀 (或Ag++Cl-=AgCl↓ ) |
② | 滴加 紫色石蕊试液(1分) ,现象有: 先变红,后褪色 | 原因有: 氯气与水反应后,溶液显酸性使紫色石蕊试液变红,产生的HClO又使红色的石蕊试液发生漂白 (或其他合理答案) |