题目内容
简单原子的原子结构可用下图的表示方法来形象表示,其中 表示质子或电子, 表示中子。则下列有关①②③的叙述中正确的是

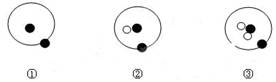
| A.①、②、③互为同位素 | B.①、②、③互为同素异形体 |
| C.①、②、③是三种化学性质不同的粒子 | D.①、②、③具有相同的质量数 |
A
解析试题分析:①表示核内1个质子,核外1个电子,②表示核内1个质子和1个中子,核外1个电子,③表示核内1个质子和2个中子,核外1个电子,三种原子的质子数相同,核外电子数相同,质量数不同,化学性质基本相同,所以互称为同位素,答案选A。
考点:考查同位素、同素异形体的区别,质量数与中子数、质子数的关系,同位素的化学性质的联系

练习册系列答案
相关题目
几种短周期元素的原子半径及主要化合价如下表: 
下列叙述正确的是 ( )
| A.X、Y元素的金属性 X<Y |
| B.一定条件下,Z单质与W的常见单质直接生成ZW2 |
| C.Y的最高价氧化物对应的水化物能溶于氨水 |
| D.Z的气态氢化物与其最高价氧化物对应的水化物可以反应 |
依据元素周期表及元素周期律,下列推断中正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的核外电子数 |
下列关于3 2He的说法正确的是
| A.3 2He原子核内含有2个中子 | B.3 2He原子核内含有3个质子 |
| C.3 2He原子核外有3个电子 | D.3 2He和4 2He是两种不同的核素 |
下列性质的递变中,正确的是
| A.O、S、Na的原子半径依次增大 |
| B.HF、NH3、SiH4的稳定性依次增强 |
| C.LiOH、KOH、CsOH的碱性依次增强 |
| D.HCl、HBr、HI的还原性依次减弱 |
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X
位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是( )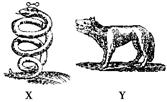
| A.原子半径X<Y |
| B.最高价氧化物对应的水化物酸性X>Y |
| C.X的氢化物具有强还原性 |
| D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性R>W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.最高价氧化物对应水化物的碱性A>C
B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B
D.C2+与A+的核外电子数相等
在11 g由D和18O组成的水中,含中子数为(NA表示阿伏加德罗常数)( )。
| A.NA | B.2NA | C.6NA | D.10NA |