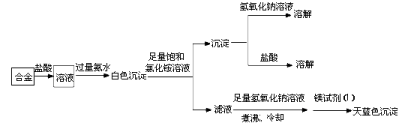
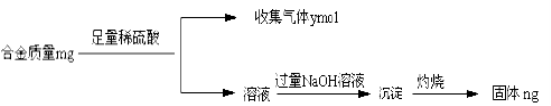
题目内容
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=__________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= _____________、CO的平衡转化率= _____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A减少Fe的量 B增加Fe2O3的量 C移出部分CO2
D提高反应温度 E减小容器的容积 F加入合适的催化剂
【答案】(1)![]() ,<;(2)0.006mol·L-1·min-1, 60%;(3)C。
,<;(2)0.006mol·L-1·min-1, 60%;(3)C。
【解析】
试题分析:(1)根据化学平衡常数的定义,则K=c(CO2)/c(CO),化学平衡常数只受温度的影响,根据表格数据,随着温度升高,化学平衡常数减小,随着温度升高,化学平衡向逆反应方向移动,根据勒夏特列原理,说明正反应为放热反应,即△H<0;
(2)1000℃时,化学平衡常数为4.0,按照题目中所给物质的量投入,此时的浓度商为1<4,说明反应向正反应方向移动,设反应过程中消耗CO为xmol,则达到平衡时c(CO2)=(1+ x)/10mol·L-1,c(CO)=(1-x)/10mol·L-1,代入化学平衡常数表达式,解的x=0.6mol,v(CO2)=0.6/(10×10)mol/(L·min)=0.006 mol/(L·min),CO的转化率=0.6/1×100%=60%;
(3)Fe、Fe2O3状态是固体,固体的浓度视为常数,因此改变Fe、Fe2O3的量,平衡不移动,故A、B错误;C、移出CO2,降低生成物的浓度,平衡向正反应方向移动,CO转化率增大,故正确;D、此反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,故错误;E、减小容器的容积,增大压强,因为反应前后气体系数之和相等,因此平衡不移动,故错误;F、催化剂对化学平衡无影响,故错误。