题目内容
9.人们对苯的认识有一个不断深化的过程.(1)烷烃中脱水2mol氢原子形成1mol双键要吸热,但1,3-环己二烯(
 )
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填稳定或不稳定).
(2)1866年凯库勒(图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分
质,但还有一些问题尚未解决,它不能解释下列ad事实(填入编号)

a.苯不能使酸性KMnO4溶液褪色
b.苯能与H2发生加成反应
c.溴苯没有同分异构体
d.邻二溴苯只有一种
(3)现代化学认为苯分子碳碳之间的键是介于单键和双键之间的特殊的化学键.
分析 (1)1,3-环己二烯(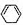 )脱去2mol氢原子变成苯却放热,苯的能量低,更稳定;
)脱去2mol氢原子变成苯却放热,苯的能量低,更稳定;
(2)若为苯的单、双键交替的正六边形平面结构,能与溴水发生加成、邻二溴苯有两种;
(3)苯分子碳碳之间的键为特殊的化学键.
解答 解:(1)1,3-环己二烯(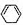 )脱去2mol氢原子变成苯却放热,苯的能量低,更稳定,则苯比1,3-环己二烯稳定,故答案为:稳定;
)脱去2mol氢原子变成苯却放热,苯的能量低,更稳定,则苯比1,3-环己二烯稳定,故答案为:稳定;
(2)若为苯的单、双键交替的正六边形平面结构,能与溴水发生加成、邻二溴苯有两种,但实际上不能与溴水发生加成,邻二溴苯有一种结构,不能解释,
故答案为:ad;
(3)苯分子碳碳之间的键不是单键和双键,为介于单键和双键之间的特殊的化学键,
故答案为:介于单键和双键之间的特殊的化学键.
点评 本题考查有机物的结构与性质,侧重苯的结构与性质的考查,明确苯中化学键的特殊性是解答的关键,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
19.难溶电解质AB2的饱和溶液中[A2+]=x mol•L-1,[B-]=y mol•L-1,则Ksp值为( )
| A. | 0.5xy2 | B. | xy | C. | xy2 | D. | 4xy2 |
20.居里夫人发现的镭是主族元素,镭原子核存有7个电子层,最外层上只有2个电子,下列关于它的描述中错误的是( )
| A. | 在化合物中呈现+2价 | B. | 它的氢氧化物呈两性 | ||
| C. | 原子半径在本族元素中最大 | D. | 单质与水反应能放出氢气 |
17.居里夫人发现了放射性元素镭(${\;}_{88}^{226}$Ra),该元素含有的中子数为( )
| A. | 88 | B. | 138 | C. | 226 | D. | 314 |
4.已知12g石墨在一定条件下转化成金刚石要吸收QkJ的热量,由此可能得出的正确结论是( )
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨和金刚石比较,石墨具有的能量较高 | |
| C. | 等质量的石墨和金刚石完全燃烧,金刚石放出的能量较多 | |
| D. | 石墨转化为金刚石是物理变化 |
14.当光束通过某红褐色液体时,从侧面可观察到一条光亮的“通路”,该红褐色液体是( )
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
1.对于锌-铜-稀硫酸组成的原电池装置,当导线中有1mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5g;
②锌片增重32.5g;
③铜片上析出11.2L H2;
④铜片上析出1mol H2.
①锌片溶解了32.5g;
②锌片增重32.5g;
③铜片上析出11.2L H2;
④铜片上析出1mol H2.
| A. | ①和③ | B. | ① | C. | ②和③ | D. | ②和④ |
18.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al.
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al.
| A. | ②④ | B. | ①④ | C. | ②③ | D. | ①② |
19.下列说法不正确的是( )
| A. | 某元素的一种核素X失去两个电子后,电子数为a,中子数为b,则该核素质量数为a+2+b | |
| B. | 某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是$\frac{a}{A+m}(A-N)×{N_A}$ | |
| C. | 我国最近合成的一种新核素${\;}_{15}^{25}$P,该核素形成的最高价氧化物化学式为P2O5 | |
| D. | 活泼金属元素R有某种核素的氯化物RClx,该氯化物中R微粒核内中子数为y,核外电子数为z,该核素可以表示为x+zx+y+zR |