��Ŀ����
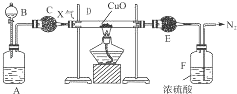
����Ŀ��A��B��C��DΪ���ֵ��ʣ�����ʱ��A��B�����壬C��D�ǹ��壮E��F��G��H��IΪ���ֻ����F����ˮ��EΪ�����Ҽ�����ˮ��Ϊ��ɫ��Һ��G����ˮ�û���ɫ��Һ����������ʼ䷴Ӧ��ת����ϵ��ͼ��ʾ 
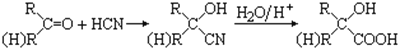
��1��д�����ֵ��ʵĻ�ѧʽ ABCD
��2��д��H+B��G�����ӷ���ʽ��
��3��д��G+I��H+D+E�Ļ�ѧ����ʽ��
��4��ij������B��Ư�ۣ� ��д����Ư�۵Ļ�ѧ����ʽ ��
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ij��С�����������ʵ�飺��ȡƯ��3.0g����ĥ���ܽ⣬���ó�250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ���������ᣨ��ʱ���������ӷ���ʽΪ���������ã�����ȫ��Ӧ����0.2molL��1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷֵ���������Ϊ������С�������λ����
���𰸡�
��1��H2��Cl2��Fe��S
��2��2Fe2++Cl2=2Fe3++2Cl��
��3��2FeCl3+H2S=2FeCl2+S��+2HCl
��4��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��2H++2I��+ClO��=I2+Cl��+H2O��47.67%
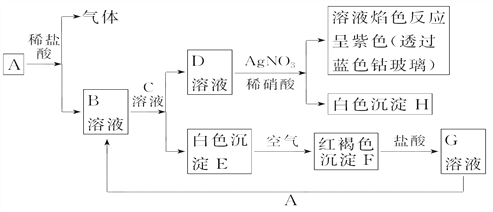
���������⣺A��B��C��DΪ���ֵ��ʣ�����ʱ��A��B�����壬C��D�ǹ��壬E��F��G��H��IΪ���ֻ����G����ˮ�û���ɫ��Һ����G�к������ӣ���Ԫ���غ��֪��CΪFe��F������ˮ��FΪFeS��DΪS��EΪ�����Ҽ�������ˮ��Ϊ��ɫ��Һ����EΪHCl��HCl��Fe��Ӧ������������AΪH2 �� BΪCl2 �� GΪFeCl3 �� HΪFeCl2 �� IΪH2S��G��I��Ӧ����FeCl2��S��HCl����1��������������֪��AΪH2 �� BΪCl2 �� CΪFe��DΪS�����Դ��ǣ�H2��Cl2��Fe�� S����2����FeCl2��������Ӧ����FeCl3 �����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl�� �� ���Դ��ǣ�2Fe2++Cl2=2Fe3++2Cl������3��FeCl3��H2S��Ӧ����FeCl2��S��HCl�����ݵ�ʧ�����غ㡢ԭ���غ���ƽ����Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+H2S=2FeCl2+S��+2HCl�� ���Դ��ǣ�2FeCl3+H2S=2FeCl2+S��+2HCl����4���ٹ�ҵ����������ʯ���鷴Ӧ��ȡƯ�ۣ���ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O�����Դ��ǣ�2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O����Ư���е�ClO�����������ԣ�I�����л�ԭ�ԣ���������Һ�з���������ԭ��Ӧ������I2��Cl����ˮ���ٸ��ݵ�ʧ�����غ㡢ԭ���غ���ƽ����Ӧ�����ӷ���ʽΪ��2H++2I��+ClO��=I2+Cl��+H2O�����������KI��Һ������������Ư����Һ��Ӧ����2H++2I��+ClO��=I2+Cl��+H2O����2Na2S2O3+I2=Na2S4O6+2NaI���ù�ϵʽCa��ClO��2��2Cl2��2I2��4Na2S2O3 ��
n[Ca��ClO��2]= ![]() n��Na2S2O3��=[20.0mL��10��3 LmL��1��0.2molL��1��
n��Na2S2O3��=[20.0mL��10��3 LmL��1��0.2molL��1�� ![]() ]��
]�� ![]() =0.01mol�����Ư������Ч�ɷֵ���������=
=0.01mol�����Ư������Ч�ɷֵ���������= ![]() ��100%=47.67%�����Դ��ǣ�2H++2I��+ClO��=I2+Cl��+H2O��47.67%��
��100%=47.67%�����Դ��ǣ�2H++2I��+ClO��=I2+Cl��+H2O��47.67%��

 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�