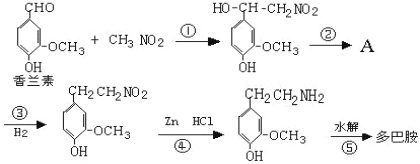
��Ŀ����
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£� �ٸ������ù�����̼��ԭ���������Ƶôֹ裬ͬʱ�õ�һ�ֿ�ȼ�����壻
�ڴֹ�������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2����
SiHCl3+H2����
��SiHCl3�������H2��1 100��1 200����¶��·�Ӧ�Ƶô��裬��֪SiHCl3����ˮ���ҷ�Ӧ���ڿ���������ȼ��
��ش�
��1����һ����ȡ�ֹ�Ļ�ѧ��Ӧ����ʽΪ ��
��2���ֹ���HCl���巴Ӧ��ȫ�������õ���SiHCl3���е�33.0�棩�к�������SiCl4���е�57.6�棩��HCl���е㩁84.7�棩���ᴿSiHCl3���õķ���Ϊ ��
��3��ʵ������SiHCl3�������H2��Ӧ��ȡ����װ����ͼ��ʾ�����Ⱥͼг�װ����ȥ���� 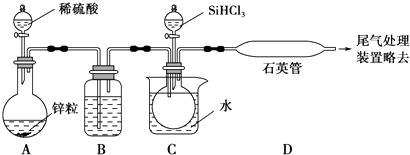
��װ��B�е��Լ��� �� װ��C�е��ձ���Ҫ���ȣ�Ŀ���� ��
�ڷ�Ӧһ��ʱ���װ��D�й۲쵽�������� �� װ��D���ܲ�����ͨ�����ܵ�ԭ���� �� װ��D�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ� ��
���𰸡�
��1��2C+SiO2 ![]() Si+2CO��
Si+2CO��
��2���������
��3��Ũ���ʹSiHCl3��������������Ӧ���й����������ɣ��¶�̫�ߣ���ͨ���������ۻ���SiHCl3+H2 ![]() Si+3HCl���ž�װ���еĿ���
Si+3HCl���ž�װ���еĿ���
���������⣺��1�������£�̼����ԭ��ʱ������CO����2C+SiO2 ![]() Si+2CO�������Դ��ǣ�2C+SiO2
Si+2CO�������Դ��ǣ�2C+SiO2 ![]() Si+2CO����2�����÷е�IJ�ͬ�ᴿSiHCl3�����������Դ��ǣ��������3�������ɵ���������ˮ��������ŨH2SO4������ȴ�ʹSiHCl3���������Դ��ǣ�Ũ���ʹSiHCl3��������������Ӧ����SiHCl3��������Ӧ�й赥�����ɣ����ݹ����ɫ�ж�Dװ���е���ɫ�仯����Ӧ�¶Ƚϸߣ���ͨ������������SiHCl3��H2��Ӧ���ɹ���Ȼ��⣬���Դ��ǣ��й����������ɣ��¶�̫�ߣ���ͨ���������ۻ���SiHCl3+H2
Si+2CO����2�����÷е�IJ�ͬ�ᴿSiHCl3�����������Դ��ǣ��������3�������ɵ���������ˮ��������ŨH2SO4������ȴ�ʹSiHCl3���������Դ��ǣ�Ũ���ʹSiHCl3��������������Ӧ����SiHCl3��������Ӧ�й赥�����ɣ����ݹ����ɫ�ж�Dװ���е���ɫ�仯����Ӧ�¶Ƚϸߣ���ͨ������������SiHCl3��H2��Ӧ���ɹ���Ȼ��⣬���Դ��ǣ��й����������ɣ��¶�̫�ߣ���ͨ���������ۻ���SiHCl3+H2 ![]() Si+3HCl�� �������ǿ�ȼ�����壬�ײ�����ը��Ϊ��ֹ��ȫ�¹ʵķ�����������ͨһ��ʱ��H2 �� ��װ���еĿ����ž������Դ��ǣ��ž�װ���еĿ�����
Si+3HCl�� �������ǿ�ȼ�����壬�ײ�����ը��Ϊ��ֹ��ȫ�¹ʵķ�����������ͨһ��ʱ��H2 �� ��װ���еĿ����ž������Դ��ǣ��ž�װ���еĿ�����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�