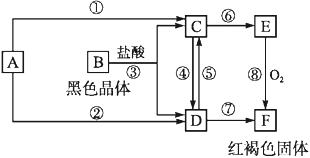
题目内容
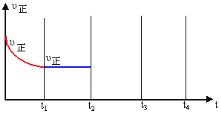
【题目】已知pOH= -lg c(OH-)。25℃时,向20.00mL 0.10mol/L弱碱MOH溶液中滴加0.10 mol/L盐酸,溶液pH、pOH随滴入盐酸体积的变化如图所示,下列说法正确的是
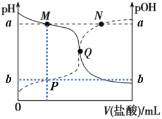
A.Q点消耗盐酸的体积大于20.00mL
B.V(HCl)=40.00mL时,溶液中存在:c(H+) - c(OH-) = c(M+) + 2c(MOH)
C.a+b的值可能大于14
D.水的电离程度:M>Q
【答案】B
【解析】
A. Q点时pH=POH,溶液呈中性,则反应后的溶液为MCl与MOH的混合溶液,从而得出消耗盐酸的体积小于20.00mL,A不正确;
B. V(HCl)=40.00mL时,溶液为MCl与HCl的混合溶液,且二者的浓度相等(不考虑MCl的水解)。在溶液中存在以下两个平衡体系:M++H2O![]() MOH + H+ ,H2O
MOH + H+ ,H2O![]() H++OH-。存在以下两个等量关系:酸电离产生的c(H+)1=c(M+)+c(MOH),M+水解生成的c(H+)2=c(MOH),水电离生成的c(H+)3= c(OH-),从而得出溶液中的c(H+) - c(OH-) = c(M+) + 2c(MOH),B正确;
H++OH-。存在以下两个等量关系:酸电离产生的c(H+)1=c(M+)+c(MOH),M+水解生成的c(H+)2=c(MOH),水电离生成的c(H+)3= c(OH-),从而得出溶液中的c(H+) - c(OH-) = c(M+) + 2c(MOH),B正确;
C.因为溶液的温度为25℃,pH=14,所以a+b=14,C不正确;
D. 在M点时,溶液呈碱性,主要发生碱的电离,水的电离受到抑制,在Q点,溶液呈中性,水的电离不受影响,所以水的电离程度:M<Q,D不正确;
故选B。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1