题目内容
短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物熔点比B的氧化物高
D.A与C可形成离子化合物
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物熔点比B的氧化物高
D.A与C可形成离子化合物
B
根据元素再周期表中的位置及有关有关核外电子的排布规律可知,A是C,B是Mg,C是Si。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性增强。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。A不正确,应该是A<C<B。非金属性越强,相应氢化物的稳定性越强,B正确。二氧化硅是原子晶体熔点高于CO2的,C不正确。碳和硅都是非金属,不能形成离子化合物,D不正确。答案选B。

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
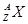 表示,则组成该元素一个原子的基本微粒总数是
表示,则组成该元素一个原子的基本微粒总数是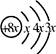 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: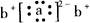 。下列叙述正确的是
。下列叙述正确的是