题目内容
【题目】甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
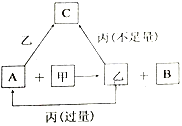
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________。
②丙元素在元素周期表中的位置是___________。
③反应A+甲→乙+B的离子方程式为______________________。
④请简述B中阳离子的检验方法__________________________________。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________。
②A的电子式为___________。
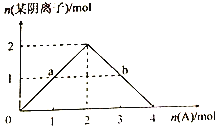
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________。
【答案】 氯气 第四周期第Ⅷ族 2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- 用试管取少量B溶液,然后向其中滴入几滴KSCN溶液,若溶液呈现血红色,证明有Fe3+存在 C ![]() < 4mol
< 4mol
【解析】根据题给信息,A+甲→乙+B 该反应为置换反应,若甲为常见气态非金属单质,三种单质中只有甲由短周期元素组成,甲与乙同主族;根据周期表中主族元素的置换规律:氯气置换溴,所以甲为氯,乙为溴,乙与丙同周期,丙为铁,A为溴化亚铁,B为氯化铁,溴与过量的铁生成溴化亚铁,溴与少量的铁生成溴化铁;
①正确答案:氯气;
② 铁元素在周期表中第四周期,第Ⅷ族;正确答案:第四周期、第Ⅷ族;
③ 溴化亚铁被氯气全部氧化为单质溴和氯化铁,该反应为置换反应;正确答案:
2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-;
④Fe3+的最简的检验方法滴加KSCN溶液,若溶液变为血红色,溶液中含有Fe3+;正确答案:用试管取少量B溶液,然后向其中滴入几滴KSCN溶液,若溶液呈现血红色,证明有Fe3+存在;
(2)甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素;
A+甲→乙+B 该反应为置换反应,金属置换非金属反应,金属镁在二氧化碳气体中燃烧,生成碳单质和氧化镁;A为二氧化碳,甲为镁,乙为碳,B为氧化镁;碳与足量的氧气燃烧变为二氧化碳,氧气不足,生成一氧化碳;
① 正确答案:C;
② 正确答案:![]()
③将二氧化碳缓慢通入氢氧化钠溶液中,当达到a点时,生成部分碳酸钠,所得混合液为氢氧化钠和碳酸钠;当二氧化碳继续通入,氢氧化钠完全反应,正好生成碳酸钠溶液,曲线达到最高点;继续通入二氧化碳,碳酸钠继续与二氧化碳反应,达到b 点,溶液变为碳酸钠和碳酸氢钠的混合液,直到最后,碳酸钠全部变为碳酸氢钠溶液; a点为氢氧化钠和碳酸钠混合液,溶液为强碱,抑制水的电离;b 点碳酸钠和碳酸氢钠的混合液,两种盐都能够促进水的电离,a<b; 正确答案:< ;从图像上看,当反应进行到最大值时,,阴离子的总量为2mol,恰好生成碳酸钠溶液,n(Na+)=4 mol, 向溶液X中逐滴加入盐酸至反应完全,,所得溶液的溶质为氯化钠,根据守恒原则,n(Cl-)=n(HCl)=4 mol,正确答案:4 mol;
.

 阅读快车系列答案
阅读快车系列答案

