题目内容
【题目】氧化铁红(Fe2O3)用途广泛,用废铁皮制取铁红的部分流程示意图如下:
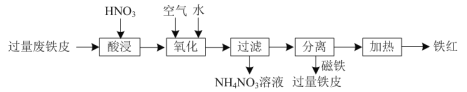
⑴“酸浸”时发生反应的离子方程式是______。
⑵“氧化”时有红褐色沉淀生成,该反应的离子方程式为______。
⑶将铁红与FeS2混合焙烧可以生成磁性氧化铁和SO2,该反应的化学方程式为______。
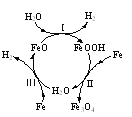
⑷“淬火”是将红热的铁器浸入水中急速冷却以增加铁器的硬度以及减缓腐蚀,反应历程如图,写出该历程中第Ⅰ步反应的方程式______。
【答案】4Fe+NO3-+10H+=4Fe2++NH4++3H2O 4Fe2++O2+10H2O=4Fe(OH)3↓+8H+ 16Fe2O3+FeS2=11Fe3O4+2SO2↑ 2FeO + 2H2O=2FeOOH+ H2↑
【解析】
“酸浸”时,废铁皮中铁被硝酸氧化为Fe2+,在“氧化”阶段,Fe2+被空气氧化为Fe3+,因有红褐色沉淀生成,则可推出生成了Fe(OH)3,经过滤得到的滤渣中含Fe(OH)3和过量的铁,滤液中含NH4NO3,再利用磁铁分离出过量的铁,将得到的Fe(OH)3加热制备得到铁红,据此分析作答。
(1)根据工艺流程可知,“酸浸”时过量的铁被硝酸氧化生成硝酸亚铁、硝酸铵和水,发生反应的离子方程式为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(2)红褐色沉淀为氢氧化铁,则“氧化”过程发生的反应为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+;
(3)根据氧化还原反应的规律可知,铁红与FeS2混合焙烧可以生成磁性氧化铁和SO2,+2价的Fe元素化合价升高到+![]() 价,-1价的S元素化合价升高到+4价,而+3价的Fe元素化合价降低到+
价,-1价的S元素化合价升高到+4价,而+3价的Fe元素化合价降低到+![]() ,根据电子转移数守恒和原子守恒可配平该氧化还原反应为:16Fe2O3+FeS2=11Fe3O4+2SO2↑;
,根据电子转移数守恒和原子守恒可配平该氧化还原反应为:16Fe2O3+FeS2=11Fe3O4+2SO2↑;
(4)第Ⅰ步反应是FeO和H2O反应生成FeOOH和H2的过程,根据氧化还原反应的规律配平可得2FeO + 2H2O=2FeOOH+ H2↑。

【题目】如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
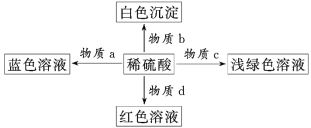
选项 | 物质a | 物质b | 物质c | 物质d |
A | Cu2(OH)2CO3 | Ba(OH)2 | Fe(OH)3 | 酚酞溶液 |
B | CuO | NaAlO2 | Fe2O3 | 紫色石蕊溶液 |
C | CuO | BaCl2 | FeO | 酚酞溶液 |
D | Cu(OH)2 | Ba(NO3)2 | FeO | 紫色石蕊溶液 |
A. AB. BC. CD. D