题目内容
7.在同温、同压下,实验测得 CO、N2和O2三种气体的混合气体的密度是 H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为 1:1,则混合气体中氧元素的质量分数为48.3%.(都以分数表示)分析 混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的物质的量为xmol、O2的物质的量为ymol,根据平均相对分子质量确定x、y关系,据此计算解答.
解答 解:混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),整理得x:y=3:1,
故氧气的质量分数=$\frac{1mol×32g/mol}{1mol×32g/mol+3mol×28g/mol}$×100%=27.6%;
其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为$\frac{1mol×32g/mol+1.5mol×16g/mol}{1mol×32g/mol+3mol×28g/mol}$×100%=48.3%,
故答案为:27.6%;48.3%.
点评 本题考查混合物计算,侧重对物质的量的有关计算,难度中等,关键是根据相对分子质量将三组分混合物看作两组分混合,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 6.72 L Cl2与足量的水反应转移的电子数为0.3NA | |
| B. | 1 mol Na被完全氧化生成Na2O2,失去2NA个电子 | |
| C. | 常温常压下,4.6g NO2和N2O4混合物中含有的原子总数为0.3NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
18.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为10NA | |
| C. | 0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28g乙烯所含共用电子对数目为6NA |
15.下列比较中,正确的是( )
| A. | 同温度同物质的量浓度时,HF比HCN易电离,NaF溶液的pH比NaCN溶液大 | |
| B. | 0.2 mol•L-1NH4Cl和0.1 mol•L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+)由大到小的顺序是:①>②>③>④ | |
| D. | 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
2.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液生成沉淀的量与滴入NaOH溶液的体积关系如图所示则原混合溶液中Al2(S04)3与MgSO4中SO42-的物质的量浓度之比为( )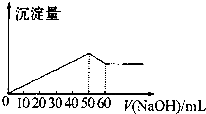

| A. | 6:1 | B. | 3:1 | C. | 3:4 | D. | 3:2 |
19.如图,有机化合物Ⅰ转化为Ⅱ的反应类型是( )
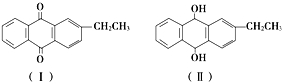

| A. | 氧化反应 | B. | 还原反应 | C. | 取代反应 | D. | 水解反应 |
16.对于反应2SO2(g)+O2(g)?2SO3(g)能增大正反应速率的措施是( )
| A. | 移去部分SO3 | B. | 增大容器容积 | C. | 降低体系温度 | D. | 通入大量O2 |
17.下列说法中不正确的是( )
| A. | 反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和 50mL 0.50mo1•L-1的硫酸充分反应,两反应测定的中和热是相等的 | |
| D. | 在101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |