题目内容
12.已知化学反应:Cl2+SO2+2H2O=H2SO4+2HCl,该反应中Cl2是氧化剂,SO2是还原剂,S元素被氧化,Cl元素被还原.分析 反应Cl2+SO2+2H2O=H2SO4+2HCl中Cl元素化合价由0价降低到-1价,S元素化合价由+4价升高到+6价,据此分析.
解答 解:反应Cl2+SO2+2H2O=H2SO4+2HCl中Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,S元素化合价由+4价升高到+6价,被氧化,SO2为还原剂
故答案为:Cl2;SO2;S;Cl.
点评 本题考查氧化还原反应,题目难度不大,注意从元素化合价的角度进行判断,把握氧化还原反应的特征和实质,注意元素化合价的变化.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.下列疾病与人体缺乏矿物质元素有关的是( )
| A. | 坏血病 | B. | 夜盲症 | C. | 骨质疏松 | D. | 糖尿病 |
3.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定含CO32- | |
| B. | 某无色溶液滴入酚酞试液显红色,该溶液呈碱性 | |
| C. | 某溶液中滴加BaCl2溶液生成不溶于稀硝酸的白色沉淀,该溶液可能含有SO42- | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
20.下面关于氢化物的叙述正确的是( )
| A. | 一个D2O分子所含的中子数为8 | B. | NH3的结构式为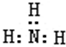 | ||
| C. | HCl的电子式为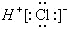 | D. | 热稳定性:H2S<HF |
17.下列化学用语正确的是( )
| A. | NaHCO3 的电离:NaHCO3?Na++H++CO${\;}_{3}^{2-}$ | |
| B. | HS-的电离:HS-+H2O?H3O++S2- | |
| C. | H3PO4的电离:H3PO4?3H++PO${\;}_{4}^{3-}$ | |
| D. | 熔融状态下NaHSO4的电离:NaHSO4═Na++SO${\;}_{4}^{2-}$ |
4.用试纸检验气体性质是一种重要的实验方法,如下表所示的实验中(可加热),下列试纸的选用、现象及对应结论均正确的一项是( )
| 选项 | 试剂 | 湿润的试纸 | 现象 | 结论 |
| A | Na2SO3,浓硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| D | Cu,浓硝酸 | 淀粉-KI试纸 | 变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
1.关于金属性质和原因的描述不正确的是( )
| A. | 金属具有光泽是因为金属阳离子吸收了某些波长的可见光造成的 | |
| B. | 金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电 | |
| C. | 金属具有良好的导热性,是因为自由电子在受热后,加快了运动速率,自由电子通过与金属离子发生碰撞,传递了能量 | |
| D. | 金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键 |
2.萜类物质中有许多都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式),关于上述四种香料,下列说法正确的是( )
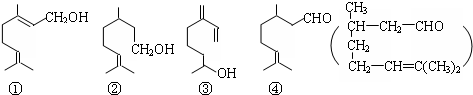

| A. | ④是②的氧化产物 | B. | ①③互为同系物 | ||
| C. | ②③均属于烯烃 | D. | ③④均能发生消去、酯化反应 |