题目内容
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是 ( )。
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化。
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
B
解析

CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
| A.滴加KI溶液时,KI被氧化,CuI是还原产物 |
| B.通入SO2后,溶液变无色,体现SO2的还原性 |
| C.整个过程发生了复分解反应和氧化还原反应 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是
| A.苦卤中加入石灰乳MgCl2+ Ca(OH)2 = CaCl2 +Mg(OH)2 |
| B.苦卤中通入氯气2Br- + Cl2 = 2Cl- + Br2 |
C.氯碱工业电解食盐水2NaCl + 2H2O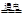 2NaOH + H2↑+ Cl2↑ 2NaOH + H2↑+ Cl2↑ |
D.电解氯化镁MgCl2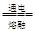 Mg + Cl2↑ Mg + Cl2↑ |
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是( )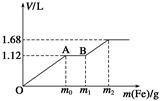
| A.开始时产生的气体为H2 |
| B.AB段产生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5 mol·L-1 |
| D.参加反应铁粉的总质量m2=5.6 g |
用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红色变为蓝绿色(反应如下),用此反应可测得司机是否是酒后驾车。此反应的氧化剂是( )
2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O
| A.H2SO4 | B.CrO3 | C.Cr2(SO4)3 | D.C2H5OH |
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130 ℃反应。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+=5H2O3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH下列说法正确的是( )。
| A.反应①不是氧化还原反应 |
| B.该生产过程不产生任何污染 |
| C.整个反应过程中,每有5.6 g Fe参加反应转移0.8 mol电子 |
| D.反应②中的氧化剂是NaNO2 |
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4??Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
| A.反应①和②均为氧化还原反应 |
| B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.Na2Cr2O7中Cr元素的化合价为+7 |
| D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子 |
 mol
mol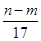 mol
mol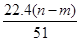 L
L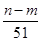 +
+