题目内容
短周期元素X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是


| A.原子半径的大小为:Z>Y>X |
| B.若X的一种单质为原子晶体,则含Y元素的盐溶液一定呈酸性 |
| C.若Y可作半导体材料,则X、Z的单质均为分子晶体 |
| D.若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
C
试题分析:根据周期表中元素的相对位置可知,X是第二周期元素,Y和Z是第三周期元素。A、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径的大小为:Y>Z>X,A不正确;B、X的一种单质为原子晶体,则X一定是碳元素,所以Y是Al元素,则含Y元素的盐溶液不一定呈酸性,例如偏铝酸钠溶液显碱性,B不正确;C、若Y可作半导体材料,则Y一定是Si。所以X、Z分别是N和S,其单质均为分子晶体,C正确;D、若Y与Z的核电荷数之和为X的4倍,则X、Y、Z分别是O、P、Cl。由于水分子间存在氢键,沸点高于氯化氢的,所以X、Z各自形成的氢化物熔沸点:X>Z,D不正确,答案选C。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目

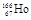 的原子核内中子数与电子数之差是
的原子核内中子数与电子数之差是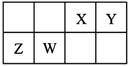
 2CA3△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3△H<0,反应10min达到平衡,生成0.2molCA3。