题目内容
【题目】无水氯化锌是有机合成中重要催化剂,无水氯化锌为白色粉末,易潮解,沸点为732℃。久置市售氯化锌常含Zn(OH)Cl,影响催化效果。实验室用HC1气体“置换”除水、升华氯化锌相结合的方法提纯市售氯化锌。
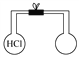
(1)选用下图所示的装置(可以重复选用)进行实验,装置接口依次连接的合理顺序为:a→___________。

(2)装置A盛氯化钠固体的仪器名称是___________,装置C中试剂是___________。
(3)实验开始时,通入HC1和N2,将管式炉I,Ⅱ升温至150℃,装置D中发生的化学反应方程式为___________;此时通入N2的目的是______________________;
(4)反应一段时间后保持管式炉I、Ⅱ温度为350℃,保证将水除尽,再______________________;(填操作)最后在氮气保护下将氯化锌刮出玻璃管外,保存待用。
(5)若称取100.00g市售氯化锌样品,经提纯最终得到高纯氯化锌100.3g,则样品中氯化锌纯度为___________。
【答案】(cd)efcdb 三颈烧瓶 浓硫酸 Zn(OH)2Cl+HCl![]() ZnCl2+H2O 稀释HCl气体,提供惰性环境 撤去管式炉Ⅱ,将管式炉Ⅰ升温至732℃以上 73.1%
ZnCl2+H2O 稀释HCl气体,提供惰性环境 撤去管式炉Ⅱ,将管式炉Ⅰ升温至732℃以上 73.1%
【解析】
根据实验目的,利用浓硫酸的高沸点、酸性,氯化钠固体、浓硫酸加热反应生成HCl,用浓硫酸干燥氯化氢;氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌;为了防止氯化锌吸水潮解,在完全吸收装置前应该增加一个干燥装置,据此进行解答。
(1)A装置制取HCl,经C装置干燥后通入D中,将反应后的尾气经C装置干燥后,再用B装置吸收未反应的HCl气体;
(2) 根据仪器的结构和性能确定仪器的名称,装置C的作用是干燥HCl气体;
(3)在加热条件下装置D中Zn(OH)Cl和HCl反应生成ZnCl2和水;HCl中添加适量氮气可稀释HCl气体,另外氮气的性质稳定;
(4) 氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌,所以实验时应该先撤去管式炉Ⅱ;
(5)根据差量法计算样品中氯化锌纯度。
(1)A装置制取HCl,经C装置干燥后通入D中,将反应后的尾气再通过C装置,以防CB装置中的水蒸气引起氯化锌水解,最后用B装置吸收未反应的HCl气体,则装置接口依次连接的合理顺序为acdefcdb;
(2)根据仪器的结构和性能确定仪器的名称是三颈烧瓶,装置C的作用是干燥HCl气体,则盛装的试剂为浓硫酸;
(3) 在加热条件下装置D中Zn(OH)Cl和HCl反应生成ZnCl2和水,发生反应的化学方程式为Zn(OH)2Cl+HCl![]() ZnCl2+H2O;实验中通入HC1和N2,其中通入N2的目的是稀释HCl气体,并提供惰性环境,防ZnCl2被氧化;
ZnCl2+H2O;实验中通入HC1和N2,其中通入N2的目的是稀释HCl气体,并提供惰性环境,防ZnCl2被氧化;
(4) 氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌,所以实验时应该先撤去管式炉Ⅱ的加热,则反应一段时间后保持管式炉I、Ⅱ温度为350℃,保证将水除尽,再撤去管式炉Ⅱ,将管式炉Ⅰ升温至732℃以上;
(5)设样品中含有Zn(OH)2Cl的质量为mg,则
Zn(OH)2Cl+HCl![]() ZnCl2+H2O △m
ZnCl2+H2O △m
134.5 136 1.5
mg 100.3.g-100g=0.3g
![]() 解得:m=26.9,则样品中氯化锌纯度为
解得:m=26.9,则样品中氯化锌纯度为![]() =73.1%。
=73.1%。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案