题目内容
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化生成X和Y(少量),X和Y中Mo价态相同,硝酸本身被还原为NO2,该反应中氧化剂与还原剂的物质的量之比为6:1,则Mo在氧化产物中的化合价为___________;
(2)已知:2Mo(s)+3O2(g)===2MoO3(s) △H1;
MoS2(s)+2O2(g)===Mo(s)+2SO2(g) △H2。
写出MoS2(s)与氧气反应生成MoO3(s)的热化学方程式_____________________________;
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
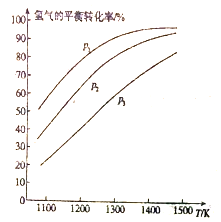
(a)不同压强下温度与H2平衡转化率的关系

(b)0.1MPa下温度与平衡时气体成分的关系
①由图(a)可知,该反应△H___________0(填“>”或“<”),p1、p2、p3由大到小的顺序为___________;
②由图(b)可知,B点时H2的平衡转化率为___________;
③A点对应的平衡常数K=___________(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
①辉钼矿应放入电解槽的___________(填“阴极区”或“阳极区”);
②阴极的电极反应式为_________________________________。
【答案】+6 2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H=△H1+2△H2 > p1<p2<p3 66.7% 4×10-4 阳极区 2H2O+2e-=H2↑+2OH-
【解析】
(1)根据电子守恒确定Mo在氧化产物中的化合价;
(2) ①2Mo(s)+3O2(g)═2MoO3(s)△H1,②MoS2(s)+2O2(g)═Mo(s)+2SO2(g)△H2,根据盖斯定律可知,②×2+①得到2MoS2(s)+7O2(g)═2MoO3(s)+4SO2(g);
(3)①升高温度平衡向吸热反应方向移动,增大压强平衡向气体总物质的量减小的方向移动;
②由图(b)可知,B点时H2的体积分数为25%,设起始时氢气的物质的量为1mol,此时氢气的转化率为α,则:
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s)
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s)
起始物质的量(mol) 1 0 0
变化物质的量(mol) α 0.5α α
平衡物质的量(mol) 1-α 0.50α α
![]() =25%,即可解得α;
=25%,即可解得α;
③图1中A点氢气和水蒸气的体积分数相等,均为40%,而由反应方程式可知一氧化碳的体积分数为水蒸气的一半,即为20%,说明氢气、一氧化碳和水蒸气的物质的量之比为2:1:2,由此根据表达式求Kp;
(4)电解池的阳极发生氧化反应,阴极发生还原反应,并结合MoS2被氧化为MoO42-和SO42-分析解题。
(1)Mo可被发烟硝酸及氢氟酸氧化生成X和Y(少量),X和Y中Mo价态相同,设Mo在氧化产物中的化合价为x价,则Mo元素从0价升高为x价,而硝酸本身被还原为NO2,氮元素从+5价降为+4价,在该反应中氧化剂与还原剂的物质的量之比为6:1,根据电子守恒可知:6×(5-4)=1×(x-0),解得:x=+6,即Mo在氧化产物中的化合价为+6;
(2)已知①2Mo(s)+3O2(g)═2MoO3(s)△H1,②MoS2(s)+2O2(g)═Mo(s)+2SO2(g)△H2,由盖斯定律计算②×2+①得:2MoS2(s)+7O2(g)═2MoO3(s)+4SO2(g)△H=△H1+2△H2;
(3) ①升高温度平衡向吸热反应方向移动,由图像(a)可知升高温度,氢气的转化率增大,说明平衡正向移动,正方向为吸热反应,即该反应△H>0;增大压强平衡向气体总物质的量减小的方向移动,对MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s)可知,增大平衡逆向移动,氢气的转化率降低,则由图像(a)可知p1<p2<p3;
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s)可知,增大平衡逆向移动,氢气的转化率降低,则由图像(a)可知p1<p2<p3;
②由图(b)可知,B点时H2的体积分数为25%,设起始时氢气的物质的量为1mol,此时氢气的转化率为α,则:
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s)
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s)
起始物质的量(mol) 1 0 0
变化物质的量(mol) α 0.5α α
平衡物质的量(mol) 1-α 0.50α α
![]() =25%,解得:α=66.7%,即B点时H2的平衡转化率为66.7%;
=25%,解得:α=66.7%,即B点时H2的平衡转化率为66.7%;
③图1中A点氢气和水蒸气的体积分数相等,均为40%,而由反应方程式可知一氧化碳的体积分数为水蒸气的一半,即为20%,说明氢气、一氧化碳和水蒸气的物质的量之比为2:1:2,Kp=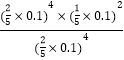 =4×10-4,;
=4×10-4,;
(4)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用性电极电解,
①用惰性电极电解时,阳极发生氧化反应,则MoS2被氧化为MoO42-和SO42-,辉钼矿应放入电解槽的阳极区;
②电解池的阴极发生还原反应,则阴极的电极反应式为2H2O+2e-=H2↑+2OH-。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案