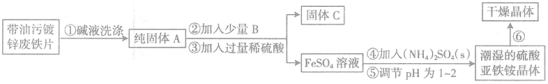
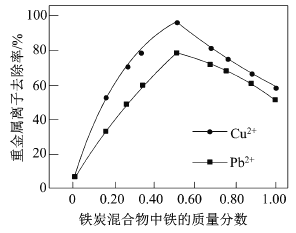
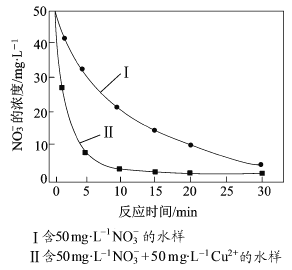
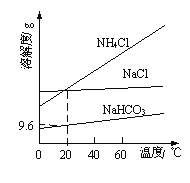
题目内容
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___ 极,该电极反应式是 。
【答案】(1)c(CH3OH)×c(H2O)/[c(CO2)×c3(H2)], +41.2;(2)CD;(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;
(4) ;(5)阴,CO2+6H++6e-==CH3OH+H2O。
;(5)阴,CO2+6H++6e-==CH3OH+H2O。
【解析】
试题分析:(1)根据化学平衡常数定义,K= c(CH3OH)×c(H2O)/[c(CO2)×c3(H2)],CO的燃烧热:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1 ①,H2燃烧热:H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1 ②,H2O(l)=H2O(g) △H=+44.0kJ·mol-1 ③,②+③-①得出:CO2(g)+H2(g)=CO(g)+H2O(g) △H=(44-285.8+283.0)kJ·mol-1=+41.2kJ·mol-1;(2)使用催化剂,对化学平衡无影响,只提高化学反应速率,故选项AB错误;C、CO2→CH3OH,此反应是放热反应,根据勒夏特列原理,降低温度,平衡向正反应方向移动,CO2的转化率提高,故正确;D、投料比不变,增加反应物的浓度,根据勒夏特列原理,提高反应物的浓度,平衡向正反应方向移动,CO2的转化率提高,故正确;E、增大CO2和H2的初始投料比,是提高CO2的量,虽然平衡向正反应方向移动,但CO2的转化率降低,故错误;(3)因为催化剂对化学平衡无影响,因此表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;(4)催化剂降低活化分子的活化能,根据表格数据,Cat.2的甲醇选择性大于Cat.1,因此图像是: ;(5)CO2中C的化合价为+4价,甲醇中C的化合价为-2价,化合价降低,根据电解原理,甲醇应在阴极上产生,因此电极反应式为:CO2+6H++6e-=CH3OH+H2O。
;(5)CO2中C的化合价为+4价,甲醇中C的化合价为-2价,化合价降低,根据电解原理,甲醇应在阴极上产生,因此电极反应式为:CO2+6H++6e-=CH3OH+H2O。