题目内容
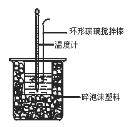
【题目】NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃, 95℃以上易爆炸,有刺激性气味,在热水中易水解。实验室可用Cl2和NH4Cl溶液反应制取NCl3。某小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。
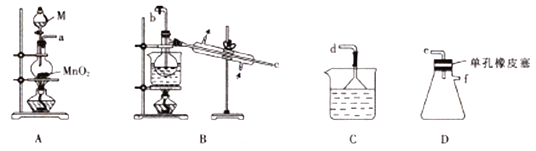
回答下列问题:
(1)仪器M中盛放的试剂为_________。
(2)各装置接口连接的顺序为__________(用小写字母表示)。
(3)当装置B的蒸馏烧瓶中出现较多油状液体后,关闭b处的活塞,应控制水浴加热的温度为_______,装置C的作用为_________。
(4)当装置D的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60℃的热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。结合化学方程式解释该现象:___________________。
(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,然后利用空气流将产物带出电解槽。电解池中产生NCl3的电极为_______(填“阴极”或“阳极”),该电极的电极反应式为________。
(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,该反应的化学方程式为__________________。
【答案】 浓盐酸 a、b、c、e、f、d 70~95℃ 吸收尾气HCl并防止倒吸 在热水中发生的反应为NCl3+3H2O![]() 3HClO+NH3↑, NCl3本身无漂白性,但在热水中会水解生成NH3·H2O 使红色石蕊试纸变蓝,而生成的HClO又使其褪色 阳极 3Cl-+NH4+-6e―=NCl3+4H+ 2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑
3HClO+NH3↑, NCl3本身无漂白性,但在热水中会水解生成NH3·H2O 使红色石蕊试纸变蓝,而生成的HClO又使其褪色 阳极 3Cl-+NH4+-6e―=NCl3+4H+ 2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑
【解析】(1)A装置制备氯气,因此仪器M中盛放的试剂为浓盐酸;(2)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:a、b、c、e、f、d;(3)由于NCl3熔点为-40℃,沸点为70℃, 95℃以上易爆炸,有刺激性气味,在热水中易水解,所以应控制水浴加热的温度为70~95℃,氯气、氯化氢都能引起空气污染,不能直接排放,可以用氢氧化钠溶液吸收,所以装置C的作用为吸收尾气HCl并防止倒吸;(4)NCl3本身无漂白性,与水反应生成次氯酸和氨气,化学方程式:NCl3+3H2O![]() 3HClO+NH3↑,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,氮元素化合价从-3价升高到+3价,发生失去电子的氧化反应,则电解池中产生NCl3的电极为阳极,该电极的电极反应式为3Cl-+NH4+-6e-=NCl3+4H+。(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,根据原子守恒可知该气体是氮气,反应的方程式为2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑。
3HClO+NH3↑,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,氮元素化合价从-3价升高到+3价,发生失去电子的氧化反应,则电解池中产生NCl3的电极为阳极,该电极的电极反应式为3Cl-+NH4+-6e-=NCl3+4H+。(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,根据原子守恒可知该气体是氮气,反应的方程式为2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑。

【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
A. A B. B C. C D. D
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
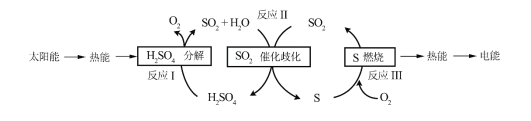
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) △H1=+551kJmol-1
反应Ⅲ:S(g)+O2(g)=SO2(g) △H3=-297kJmol-1
反应Ⅱ的热化学方程式:____________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如右图所示,p2______p1(填“>”或“<”),得出该结论的理由是__________。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下,将ii补充完整
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+______=______+______+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象,(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4molL-1 KI | amolL-1 KI 0.2molL-1H2SO4 | 0.2molL-1H2SO4 | 0.2molL-1 KI 0.0002 molI2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
① B是A的对比实验,则a=______。
②比较A、B、C,可得出的结论是______。
③实验表明,SO2的歧化反应速率D>A.结合i,ii反应速率解释原因:______。