题目内容
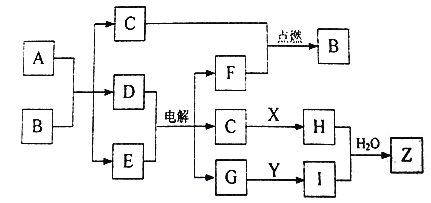
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A是常用的漂白液的有效成分,C为黄绿色气体,气体F在C中燃烧产生苍白色火焰,D是海水中含量最多的一种盐,X、Y是两种常见的金属,H遇到KSCN溶液时变成红色,Z是两种氢氧化物沉淀的混合物。
请回答下列问题:
(1)B的电子式为_________________。
(2)Z中所含沉淀有A1(OH)3和_________________。
(3)写出Y和溶液G反应的离子方程式:_______________________________。
(4)写出A和B反应的化学方程式:________________________________。
【答案】![]() Fe(OH)32Al+2H2O+2OH-=2AlO2-+3H2↑NaClO+2HCl =NaCl+H2O+Cl2↑
Fe(OH)32Al+2H2O+2OH-=2AlO2-+3H2↑NaClO+2HCl =NaCl+H2O+Cl2↑
【解析】本题考查元素推断,从元素及其化合物的性质找出突破口,A是常用漂白液的有效成分,即A为NaClO,C为黄绿色气体,即C为Cl2,气体F在C中燃烧产生苍白色火焰,即氢气在氯气中燃烧,F为H2,根据转化关系,B为HCl,D是海水中含量最多的一种盐,即D是NaCl,H遇到KSCN,变为红色,说明H中含有Fe3+,因此X为Fe,H为FeCl3,根据问题(2),Y为Al,D+E反应的条件是通电,因此是电解食盐水,因此G为NaOH,I为NaAlO2,(1)根据上述推断,B为HCl,属于共价化合物,其电子式为:![]() ;(2)H+I发生双水解反应3AlO2-+Fe3++6H2O=Fe(OH)3↓+3Al(OH)3↓,另一种沉淀是Fe(OH)3;(3)发生的反应是:2Al+2H2O+2OH-=2AlO2-+3H2↑;(4)发生的反应是:NaClO+2HCl =NaCl+H2O+Cl2↑。
;(2)H+I发生双水解反应3AlO2-+Fe3++6H2O=Fe(OH)3↓+3Al(OH)3↓,另一种沉淀是Fe(OH)3;(3)发生的反应是:2Al+2H2O+2OH-=2AlO2-+3H2↑;(4)发生的反应是:NaClO+2HCl =NaCl+H2O+Cl2↑。

 阅读快车系列答案
阅读快车系列答案