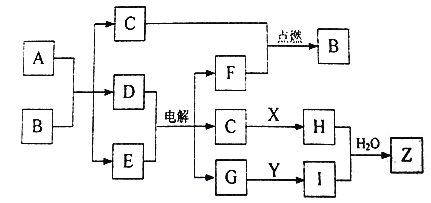
题目内容
【题目】将3.80g碳酸钠和碳酸氢钠的固体混合物加入120mL 0.5molL-1的的盐酸中,充分反应后得到溶液W。下列说法一定正确的是
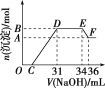
A. 溶液W中含有盐酸 B. 生成气体的物质的量与消耗盐酸体积的关系如右图
C. 将溶液W蒸发结晶所得固体质量为3.51g D. 将固体混合物充分加热后再加入120mL 0.5molL-1的盐酸,所得溶液组成和W相同
【答案】CD
【解析】设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,根据题意有:106x+84y=3.8,假设混合物与盐酸恰好完全反应,碳元素全部转化成CO2,Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2↑+H2O,因此有2x+y=120×10-3×0.5,解得x=y=0.02mol,说明假设正确,A、根据上述分析,盐酸全部反应,W溶液没有盐酸,故错误;B、根据上述分析,以及碳元素守恒,生成CO2的物质的量为0.04mol,故错误;C、根据分析,最后的得到物质为NaCl,根据Na元素守恒,m(NaCl)=(0.02×2+0.02)×58.5g=3.51g,故正确;D、根据钠元素守恒和氯元素守恒,固体混合物充分加热后,再加入120mL 0.5molL-1的盐酸,所得溶液组成和W相同,故正确。

练习册系列答案
相关题目