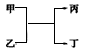题目内容
现有甲、乙、丙、丁4种短周期元素,甲元素M电子层上的电子数是K电子层上电子数的一半,该元素的单质在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;乙元素的单质在室温下、冷的浓硫酸或空气中,表面都能生成致密的氧化膜;丙元素的单质在室温下是黄绿色气体;丁元素的阴离子与丙元素的阴离子具有相同的电子层结构.
(1)写出甲、乙、丙、丁4种元素的符号.甲:________ 乙:________ 丙:________ 丁:________
(2)甲元素和乙元素最高价氧化物对应的水化物碱性较强的物质的化学式是________.
(3)由甲元素和丁元素组成的盐溶液的pH________7(填>、<、=).
(4)将乙元素的单质(除去氧化膜)投入浓氯化铜溶液中,在其表面很快出现一层红色物质,产生气体的速率逐渐加快,触摸容器壁得知溶液温度迅速升高,收集气体,检验其具有可燃性.产生的气体是________(写化学式).请从有关能量、是否有电化学作用等方面分析开始阶段产生气体的速率不断加快的原因:________________.
答案:
解析:
解析:
|
(1)甲:Na 乙:Al 丙:Cl 丁:S (2)NaOH (3)> (4)H2 铝先置换出氯化铜中的铜,然后在金属表面形成无数微小的原电池,负极发生的反应是:Al-3e-=Al3+,正极发生的反应是:Cu2++2e-=Cu 2H++2e-=H2↑,所以溶液中有气体产生;由于该反应是放热反应,因此溶液温度迅速升高,产生氢气的速率不断加快. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

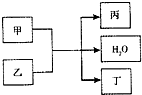 现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下:
现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下: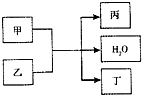 现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下:
现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下: