题目内容
【题目】(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
![]()
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
【答案】(1)1(1分),4:3(2分);(2)3:1(2分);
(3)2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+(2分);
(4)阳极(2分),2H++2HSO3-+2e-=S2O42-+2H2O(2分);
(5)NO2-的浓度为ag/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:![]() .设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒解得V=243a.
.设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒解得V=243a.
【解析】试题分析:(1)①在反应NO +O3=NO2+O2中,每产生1mol 的氧气,转移电子的物质的量是2mol,现在生成标准状况下11.2 L O2时,n(O2)=0.5mol,所以转移电子的物质的量是1mol。②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,反应方程式是:6NO2+4 CO(NH2)2=7N2+4CO2+8H2O,在该反应中,NO2是氧化剂,变为还原产物N2;CO(NH2)2是还原剂,变为氧化产物N2,所以氧化产物与还原产物的质量比为8:6=4:3。(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则根据电子守恒及原子守恒,可得方程式:3CO+2 NOx →N2+3CO2,化学方程式中CO2和N2的化学计量数比,3:1;(3)在酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,根据电子守恒、电荷守恒、原子守恒可得生成等物质的量的NO3-和NO2-时的离子方程式是2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;(4)用质子交换膜电解槽电解Ce3+使得Ce4+再生,再生时Ce3+失去电子,被氧化,所以生成的Ce4+在电解槽的阳极,同时在另一极发生还原反应生成S2O42一,反应的电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O;(5)在进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,NO2-的浓度为ag/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:![]() .设消耗标况下氧气的体积是V,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒
.设消耗标况下氧气的体积是V,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0).根据电子守恒![]() = V÷22.4×2×(2-0)。解得V=243a.
= V÷22.4×2×(2-0)。解得V=243a.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________。
②CH3COONa溶液呈碱性,原因是__________(填“CH3COO-”或“Na+”)水解引起的。
③ 在CH3COONa溶液中,c(Na+)_______c(CH3COO-)、(填“>”“=”或“<”)
(2)已知:反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=131.3kJ/mol
CO(g)+H2(g)的△H=131.3kJ/mol
① 该反应是反应__________(填“吸热”或“放热”)。
② 若反应消耗24gC(s),则反应的热效应为__________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol 通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2 min 内,vCO=__________。
② 该温度下,此反应的平衡常数表达式K=_________。
③ 其他条件不变,再充入0.1molCO和0.1molH2O(g),达到平衡时CO 的休积分数_____(填“增大”、“减小”或“不变”)。
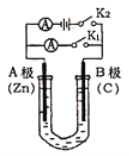
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
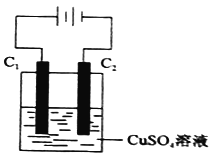
① C1作_________(填“阳极”或”阴极”)。
② C2极电极反应式为____________。