题目内容
【题目】已知把ag金属铜投入一定量浓硝酸中,反应开始产生红棕色气体,随着反应的进行,产生的气体颜色逐渐变浅,最后变为无色,反应过程中共收集到标准状况下气体VL,剩余固体bg。
(1)写出反应过程中发生的化学反应___、___。
(2)在产生无色气体的反应中___是还原剂;被还原的HNO3与参加反应的HNO3的质量之比为___;当有1molHNO3参加反应时,该反应转移的电子的物质的量为___。
(3)在上面反应过程中,参加反应的HNO3的物质的量为___。
【答案】Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu 1∶4 0.75mol (![]() +
+![]() )mol
)mol
【解析】
(1)硝酸的浓度不同,反应生成的产物不同,浓度较高生成二氧化氮,较低生成气体一氧化氮;
(2)硝酸被还原成含氮气体,未被还原的硝酸最后生成了Cu(NO3)2 ,写出反应方程式分析解答;
(3)反应前后氮原子守恒的,而反应后氮原子存在于硝酸铜和含氮气体当中,由此列出等式计算得出答案。
(1)浓硝酸氧化能力强,最后生成NO2,稀硝酸氧化性弱,最后生成NO ,所以反应开始是Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O,随着反应进行,硝酸浓度降低,发生反应3Cu+ 8HNO3(稀)= 3Cu(NO3)2+ 2NO↑+4H2O;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)产生无色气体,则是铜与稀硝酸的反应3Cu+ 8HNO3(稀)=3Cu(NO3)2+ 2NO↑+4H2O,其中Cu是还原剂,未被还原的HNO3最后形成Cu(NO3)2 ,从反应方程式中可以看出,被还原的HNO3(2mol)与参加反应的HNO3(8mol)的质量之比为1:4;1mol硝酸参加反应,则有![]() molCu参与反应,转移电子
molCu参与反应,转移电子![]() × 2mol=0.75mol;
× 2mol=0.75mol;
故答案为:Cu;1∶4;0.75mol;
(3 )根据氮原子反应前后守恒,则n总=2n硝酸铜+n气体= 2n铜+ n气体,由此可得参与反应的硝酸的物质的量是(![]() )mol=(
)mol=(![]() )mol,
)mol,
故答案为:(![]() )mol。
)mol。

 阅读快车系列答案
阅读快车系列答案【题目】生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______(填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
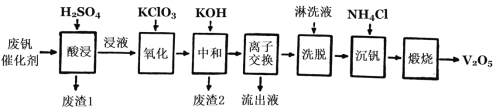
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________,同时V2O5转化为VO2+。“废渣1”的主要成分是________。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____。
(6)“煅烧”中发生反应的化学方程式2NH4VO3![]() V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__kg(保留小数点后一位)。


