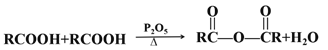题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) △H=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
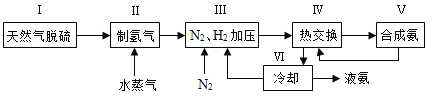
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:____________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是_________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为________。
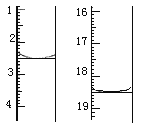
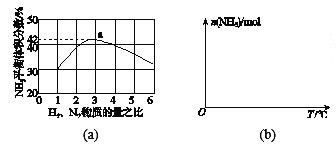
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。_____
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_________。简述本流程中提高合成氨原料总转化率的方法:______________________________________。
【答案】 2NH4HS+O2![]() 2NH3·H2O+2S↓ a 90% 14.5%
2NH3·H2O+2S↓ a 90% 14.5% 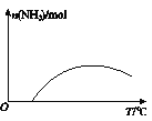 Ⅳ 对原料气加压;分离液氨后,未反应的N2、H2循环使用
Ⅳ 对原料气加压;分离液氨后,未反应的N2、H2循环使用
【解析】(1)H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2![]() 2NH3·H2O+2S↓(2)反应①CH4(g)+H2O(g)CO2(g)+3H2(g)△H=+206.4 kJmol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大,故a符合;b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H2百分含量不一定增大,故b不符合;c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c不符合;d.降低压强,反应速率减小,平衡逆向进行,氢气百分含量减小,故d不符合;故选a;
2NH3·H2O+2S↓(2)反应①CH4(g)+H2O(g)CO2(g)+3H2(g)△H=+206.4 kJmol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大,故a符合;b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H2百分含量不一定增大,故b不符合;c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c不符合;d.降低压强,反应速率减小,平衡逆向进行,氢气百分含量减小,故d不符合;故选a;
利用反应②,将CO进一步转化,可提高H2产量,若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,
CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.2 kJmol-1
起始量(mol) 0.20.18+x 00.8
变化量(mol) xxxx
平衡量(mol)0.2-x 0.18 xx+0.8
则0.2-x+x+x+0.8=1.18,x=0.18
则CO转化率为![]() ;
;
(3)依据反应特征N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142/4=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图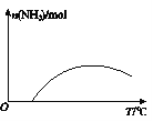
(5)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率.

【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。
已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中氮元素的化合价是______,用离子方程式表示NaCN溶液呈强碱性的原因:________。
(2)已知:
物质 | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=6.2×10-10 | Ka1=4.5×10-7,Ka2=4.7×10-11, |
则向NaCN溶液通入少量CO2反应的离子方程式:_______________。
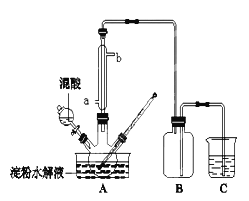
(3)用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
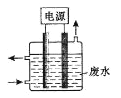
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e- =H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________;
(5)过碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,也可用于含氰废水的消毒处理。
① 下列物质中,不会引起过碳酸钠发生氧化还原反应的有___________。
A. FeC13 B. CuSO4 C. Na2SiO3 D. KCN
② 已知 6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O.现称取0.2000g 过碳酸钠样品于250mL 锥形瓶中,加50mL蒸溜水溶解,再加50mL 2.0000molL-1H2SO4,用0.0200 molL-1 KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为______。