题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,56 g乙烯和丙烯的混合气中含有的碳原子数为4NA
B. 1.2 g NaHSO4晶体中含有的阳离子和阴离子的总数为0.03NA
C. 12 g金刚石中含有的共价键数为4NA
D. 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
【答案】A
【解析】A.56g乙烯和丙烯的混合气中含有n(CH2)= ![]() =4mol,n(C)=4mol,碳原子数为4NA,故A正确;B.1.2gNaHSO4晶体的物质的为
=4mol,n(C)=4mol,碳原子数为4NA,故A正确;B.1.2gNaHSO4晶体的物质的为![]() =0.01mol,NaHSO4晶体以钠离子和硫酸氢根离子构成,因此离子总物质的量为0.02mol,即为0.02NA个离子,故B错误;C.金刚石中平均一个C构成2条共价键,12g金刚石含有1molC、NA个C,含有共价键2NA,故C错误;D.1molFe2+被氧化为1molFe3+,失去电子数为1mol×(3-2)=1mol电子,即转移电子数为NA,故D错误;故答案为A。
=0.01mol,NaHSO4晶体以钠离子和硫酸氢根离子构成,因此离子总物质的量为0.02mol,即为0.02NA个离子,故B错误;C.金刚石中平均一个C构成2条共价键,12g金刚石含有1molC、NA个C,含有共价键2NA,故C错误;D.1molFe2+被氧化为1molFe3+,失去电子数为1mol×(3-2)=1mol电子,即转移电子数为NA,故D错误;故答案为A。

 名校课堂系列答案
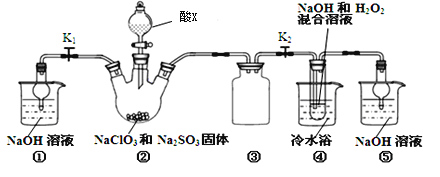
名校课堂系列答案【题目】卤素单质都是重要的化工原料。其课外小组在实验室完成了下列有关卤素单质的实验。
(1)设计以下装置(夹持装置已略去),进行实验,模拟海水提溴的部分过程。

①a是一种黄绿色气体。A装置中通入a气体的目的是____________________(用离子方程式表示)。
②A装置中通入a气体一段时间后,停止通入,改通入热空气。通入热空气的目的是____________________。
③反应过程中,B装置中有SO42-生成。则气体b的化学式是____________________。检验B装置的溶液中含有SO42-的方法是______________________________。
④C装置的作用是________________________________________。
⑤该小组同学向反应后B装置的溶液中通入a气体,充分反应得到混合液。一位同学根据溴的沸点是59℃,提出采用__________方法从该混合液中分离出溴单质;另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,该过程中应用的方法包括______________________________。
(2)设计实验:比较C12、Br2、I2三种单质的氧化性强弱。实验记录如下:
实验步骤 | Ⅰ
| Ⅱ
| Ⅲ
|
实验现象 | 溶液变为黄色 | 溶液变为黄色 | 溶液变为蓝色 |
实验结论 | 氧化性:Cl2>Br2 | 氧化性:Br2>I2 | |
①你认为上述实验设计(填“”或“不能”__________达到实验目的,理由是______________________________。
②Cl2、Br2、I2三种单质氧化性的递变性,用原子结构解释原因:________________________________________。