题目内容
下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是 (填写编号)。
(2)下列操作合理的是 (填字母)
A.用25mL碱式滴定管量取20.00mLNaHCO3
B.用托盘天平准确称量10.20克碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶

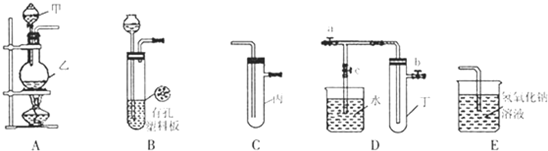
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为 mL。
(4)图甲表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积为 mL;图乙表示25 mL酸式滴定管中某酸的体积,D与E 之间的刻度差为1 mL,如果刻度D为4,则该酸式滴定管中液体体积的读数为 mL。

图甲 图乙
(1) ab (2) AD (3) 26.10mL (4)3.2mL 4.60mL
【解析】
试题分析:(1)量筒和容量瓶没有“0”刻度;(2)托盘天平精确度为0.1g,不能精确称量10.20克碳酸钠固体;用100mL的量筒量取3.2mL浓硫酸造成的误差较大,应该用10mL的量筒量取,故B、C错误,A、D操作合理;(3)滴定前液面读数为0.00mL,滴定后液面读数为26.10mL,故所用盐酸的体积为26.10ml;(4)量筒刻度自下而上逐渐增大,若甲图中刻度A为4,则B为3,最小刻度为0.2mL,根据液面高度可判断量筒中液体的体积为3.2mL;滴定管刻度自上而下依次增大,乙图中如果刻度D为4,则E为5,最小刻度为0.1mL,由液面高度可判断滴定管中液体体积的读数为4.60mL(注意精确到0.01mL)。
考点:考查常用定量仪器的使用方法。