题目内容
【题目】HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,不正确的是

A. pH=9时,c(A-)=c(HA)
B. x=0时,1
C. HA的电离平衡常数ka=10-5
D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
【答案】C
【解析】A. 由图可知,pH=9时,HA、A-的物质的量分数相同,所以c(A-)=c(HA),A正确;B. HA为一元弱酸, 0.1mol/LHA溶液中,10-7 mol/L<c(H+)<0. 1mol/L x=0时,所以,1<pH<7,B正确;C. pH=9时,c(H+)=10-9 mol/L,c(A-)=c(HA),所以,HA的电离平衡常数ka=10-9,C不正确;D. x=10时,两者恰好完全反应,由物料守恒可得,c(A-)+c(HA)=c(Na+)=0.05mol/L,D正确。本题选C。

【题目】“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
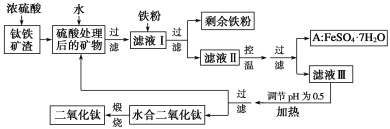
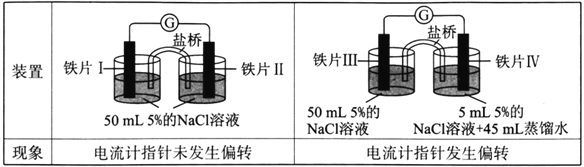
(1)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨.
①a表示____离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示______.E表示_______.
②阳极的电极反应式为___________________________________.
(2)Na2SO3溶液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO3﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
①Na2SO3溶液显______性,理由(请用离子方程式表示)_______________________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ____
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
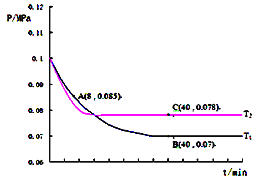
①图中A点时,SO2的转化率为________.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,C点的正反应速率vc(正)与A点的逆反应速率vA (逆)的大小关系为vc(正)_____vA (逆)(填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=__________(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).