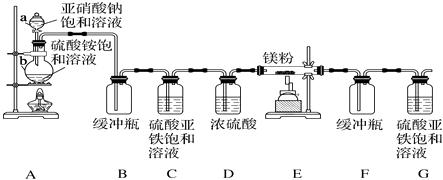
题目内容
【题目】根据题意填空
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为 , 此时水的电离受到
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣ , 下列分析结果肯定错误的是
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11;84消毒液中通入少量的CO2 , 该反应的化学方程式为
【答案】
(1)4或10;抑制
(2)12
(3)C
(4)中;![]()
(5)NaClO+CO2+H2O═HClO+NaHCO3
【解析】解:(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液中满足:c(H+)=c(OH﹣)=1×10﹣10mol/L,则该溶液抑制了水的电离,为酸性或碱性溶液,溶液的pH可能为4或10,
所以答案是:4或10;抑制;(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液和100mL 0.4molL﹣1的KOH溶液混合,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(KOH)=0.4mol/L×0.1L=0.04mol,KOH有剩余,混合溶液中c(OH﹣)= ![]() mol/L=0.1mol/L,c(H+)=
mol/L=0.1mol/L,c(H+)= ![]() mol/L=10﹣12mol/L,pH=12,所以答案是:12;(3)A.当溶液为酸性时,可以满足关系:c(Y﹣)>c(X+)>c(H+)>c(OH﹣),故A正确;
mol/L=10﹣12mol/L,pH=12,所以答案是:12;(3)A.当溶液为酸性时,可以满足关系:c(Y﹣)>c(X+)>c(H+)>c(OH﹣),故A正确;
B.当溶液呈碱性时可以满足c(X+)>c(Y﹣)>c(OH﹣)>c(H+),故B正确;
C.该关系c(H+)>c(Y﹣)>c(X+)>c(OH﹣)无法了电荷守恒,故C错误;
D.当溶液呈碱性,且YOH远远过量时可以满足c(OH﹣)>c(X+)>c(H+)>c(Y﹣),故D正确;
所以答案是:C;(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl﹣)=0.005mol/L,根据物料守恒得c(NH3H2O)=(0.5a﹣0.005)mol/L,根据电荷守恒得c(H+)=c(OH﹣)=10﹣7mol/L,溶液呈中性,NH3H2O的电离常数Kb= ![]() =
= ![]() =
= ![]() ,
,
所以答案是:中; ![]() ; (5)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性H2CO3>HClO>HCO3﹣ , 则次氯酸钠和二氧化碳水反应生成碳酸氢钠和次氯酸,反应方程式为NaClO+CO2+H2O═HClO+NaHCO3 ,
; (5)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性H2CO3>HClO>HCO3﹣ , 则次氯酸钠和二氧化碳水反应生成碳酸氢钠和次氯酸,反应方程式为NaClO+CO2+H2O═HClO+NaHCO3 ,
所以答案是:NaClO+CO2+H2O═HClO+NaHCO3 .

【题目】尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示. 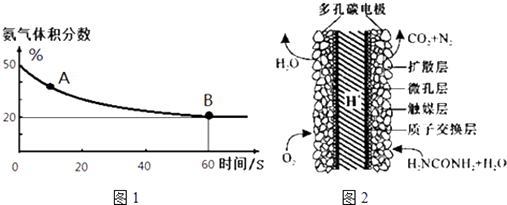
A点的正反应速率v正(CO2)B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为 .
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 .
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=;(填具体数值)NH4+水解平衡常数值为 .
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式: .