题目内容
利用15N可以测定亚硝酸盐对地下水质的污染情况.(1)下列说法正确的是
A.14N与15N为同种核素
B.14N的第一电离能小于14C
C.15NH3与14NH3均能形成分子间氢键
D.CH315NH2与CH3CH214NH2互为同系物
(2)15N的价层电子排布图为

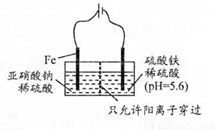
(3)工业上电解法处理亚硝酸盐的模拟工艺如图.
已知:阳极区发生化学反应:2N02-+8H++6Fe2+═N2↑+6Fe3++4HzO
①阳极电极反应方程式是
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为
③若电解时电路中有0.6mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4
分析:(1)A.质子数相同而中子数不同的核素互为同位素;
B.同周期元素从左到右元素的电负性逐渐增大,第一电离能逐渐增大但ⅤA族大于ⅥA族元素;
C.氢键是X-H…Y形式的键,X为氮氧氟;
D.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.
(2)氮原子最外层有5个单子;CsCl属于简单立方晶胞;根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂化类型;
(3)①活泼金属做阳极,金属失电子;
②阳离子在阴极放电;
③根据电子守恒求出NaNO2的物质的量;然后根据元素守恒解题.
B.同周期元素从左到右元素的电负性逐渐增大,第一电离能逐渐增大但ⅤA族大于ⅥA族元素;
C.氢键是X-H…Y形式的键,X为氮氧氟;
D.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.
(2)氮原子最外层有5个单子;CsCl属于简单立方晶胞;根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂化类型;
(3)①活泼金属做阳极,金属失电子;
②阳离子在阴极放电;
③根据电子守恒求出NaNO2的物质的量;然后根据元素守恒解题.
解答:解:(1)A.14N与15N为中子数不同,不是同种核素,互为同位素,故A错误;
B.N的价电子层为半充满结构,更加稳定,故B错误;
C.含有N元素,故能形成氢键,故C正确;
D.二者结构相似,分子组成相差一个“CH2”,故D正确,
故答案为:CD;
(2)15N的价层电子排布图为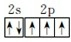 ;CsCl属于简单立方晶胞,8个Cl- (或Cs+)位于立方体的八个顶点,立方体中心为Cs+(或Cl-),所以每个Cs的周围,有8个Cl-,每个Cl-周围有8个Cs+,15NH4Cl的晶胞与CsCl相同,即阴阳离子的配位数均为8;铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,故答案为:
;CsCl属于简单立方晶胞,8个Cl- (或Cs+)位于立方体的八个顶点,立方体中心为Cs+(或Cl-),所以每个Cs的周围,有8个Cl-,每个Cl-周围有8个Cs+,15NH4Cl的晶胞与CsCl相同,即阴阳离子的配位数均为8;铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,故答案为: ;8;sp3杂化;
;8;sp3杂化;
(3)①活泼金属做阳极,金属失电子:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
②阳离子在阴极放电,氢离子浓度大了放电生成氢气,故答案为:H2;强;
③由电极反应知转移0.6 mol电子时生成Fe2+ 0.3 mol,故消耗NaNO2 0.1mol,根据钠元素守恒可知生成Na2SO40.05 mol,故答案为:0.05.
B.N的价电子层为半充满结构,更加稳定,故B错误;
C.含有N元素,故能形成氢键,故C正确;
D.二者结构相似,分子组成相差一个“CH2”,故D正确,
故答案为:CD;
(2)15N的价层电子排布图为
 ;CsCl属于简单立方晶胞,8个Cl- (或Cs+)位于立方体的八个顶点,立方体中心为Cs+(或Cl-),所以每个Cs的周围,有8个Cl-,每个Cl-周围有8个Cs+,15NH4Cl的晶胞与CsCl相同,即阴阳离子的配位数均为8;铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,故答案为:
;CsCl属于简单立方晶胞,8个Cl- (或Cs+)位于立方体的八个顶点,立方体中心为Cs+(或Cl-),所以每个Cs的周围,有8个Cl-,每个Cl-周围有8个Cs+,15NH4Cl的晶胞与CsCl相同,即阴阳离子的配位数均为8;铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,故答案为: ;8;sp3杂化;
;8;sp3杂化;(3)①活泼金属做阳极,金属失电子:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
②阳离子在阴极放电,氢离子浓度大了放电生成氢气,故答案为:H2;强;
③由电极反应知转移0.6 mol电子时生成Fe2+ 0.3 mol,故消耗NaNO2 0.1mol,根据钠元素守恒可知生成Na2SO40.05 mol,故答案为:0.05.
点评:本题考查电离能、请柬、原子杂化类型的判断和电解原理,根据“杂化轨道数=δ键数+孤对电子对数”来解答即可,原子杂化类型的判断是高考的热点,所以是学习的重点,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目