题目内容
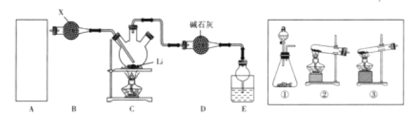
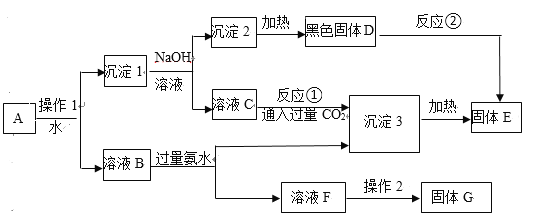
【题目】某同学设计如下实验,测定Na2CO3、NaHCO3和CaCO3固体混合物中钠元素的质量分数。实验过程如图所示:
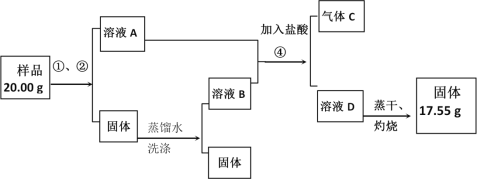
请回答:
(1)操作①、②的名称依次为_________。
(2)气体C是_________(填化学式);溶液D是_________(填化学式);
(3)原样品中钠元素的质量分数为_________________。
【答案】溶解、过滤 CO2 NaCl 34.5%
【解析】
测定Na2CO3、NaHCO3和CaCO3固体混合物中钠元素的质量分数,首先根据混合物组成成分溶解性的不同,通过先溶解再过滤的方法,可除去混合物中的碳酸钙;接着根据反应流程图可知,混合物中钠元素全部转化为氯化钠,由最后得到的氯化钠的质量,根据化学变化前后元素质量不变,计算混合物中钠元素的质量,钠元素质量与混合物质量的比可计算原样品中钠元素的质量分数,据此解答。
(1)通过溶解把碳酸钙与溶液初步分离,然后经过过滤除去混合物中的碳酸钙,所以操作①、②的名称依次为溶解、过滤,故答案为:溶解、过滤;
(2)溶液A和溶液B的主要成分为:Na2CO3和NaHCO3;加入盐酸,发生反应为:Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O,所以气体C为CO2,溶液D为NaCl,故答案为:CO2;NaCl;
(3)所得17.55g氯化钠中钠元素的质量为:17.55g×![]() ×100%=6.90g,原样品中钠元素的质量分数为:
×100%=6.90g,原样品中钠元素的质量分数为:![]() ×100%=34.5%,故答案为:34.5%。
×100%=34.5%,故答案为:34.5%。

 阅读快车系列答案
阅读快车系列答案【题目】大气污染物NOx、SO2和可吸入颗粒物(PM2.5)等会危害人体健康,影响动植物生长,因此应加强对其监测和治理。请回答:
⑴为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出。写出NO被CO还原的化学方程式:______________。
⑵某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如下:
离子 | H+ | Na+ |
|
|
|
浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
试样中c(H+)=______mol/L。
【题目】根据下列实验操作和现象得出的结论正确的是
操作 | 现象 | 结论 | |
A | 将 | 溴水和酸性高锰酸钾溶液均褪色 |
|
B | 向 | 先产生白色沉淀,后产生红褐色沉淀 |
|
C | 向滴有酚酞的 | 有白色沉淀生成,溶液红色变浅 |
|
D | 将 | 产生白色沉淀 | 酸性: |
A.AB.BC.CD.D
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
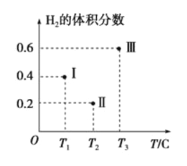
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。