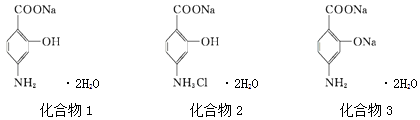
题目内容
【题目】已知草酸镍晶体(NiC2O42H2O)难溶于水,工业上从废镍催化剂(主要成分是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
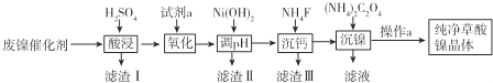
已知:①相关金属离子生成氢氧化物沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀.
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:______________________________________。
(2)试剂a是一种绿色氧化剂,写出氧化时反应的离子方程式:__________________________________。
(3)调节pH的范围为________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成:_____________。
(4)写出沉镍时反应的离子方程式:________________________________________________。证明Ni2+已经沉淀完全的实验步骤及现象是_____________________________________。当Ca2+沉淀完全时,溶液中c(F-)>________mol·L-1。
(5)操作a的内容是_____________________________________________________________。
【答案】 把废镍催化剂粉碎(或适当加热,适当增大酸的浓度或提高搅拌速率) 2Fe2++H2O2+2H+=2Fe3++2H2O 5.0≤pH<6.8 加入Ni(OH)2消耗溶液中的H+,促使Fe3+、Al3+的水解平衡右移,使铁离子,铝离子转化为相应的沉淀 Ni2++C2O42-+2H2O=NiC2O4·2H2O↓ 取适量上层清液放入试管中,继续滴加(NH4)2C2O4溶液,无沉淀生成 ![]() 过滤、洗涤,干燥
过滤、洗涤,干燥
【解析】(1)提高酸浸的速率,其实就类似于如何加速溶解,所以方法为:粉碎、搅拌、加热等。
(2)绿色氧化剂是指H2O2,在酸性条件下将亚铁离子氧化为铁离子,方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)调节pH的目的是使铁离子和铝离子完全转化为对应的氢氧化物沉淀,再过滤除去杂质,同时要保证溶液中的镍离子不沉淀,所以应调节5.0≤pH<6.8。加入氢氧化镍会与溶液中的氢离子反应,使体系的pH升高,从而使铁离子和铝离子的水解平衡正向移动,将其转化为氢氧化物沉淀进行分离。
(4)加入草酸铵得到草酸镍晶体沉淀,所以方程式为:Ni2++C2O42-+2H2O=NiC2O4·2H2O↓。证明镍离子沉淀完全,就是证明在溶液中已经不存在镍离子,所以方法为:取适量上层清液于试管中,继续滴加(NH4)2C2O4溶液,无沉淀生成。当Ca2+沉淀完全时,其离子浓度小于1×10-5mol/L,根据KSP表达式进行计算,得到溶液中c(F-)>![]() mol·L-1。
mol·L-1。
(5)操作a是为了从草酸镍的悬浊液中得到草酸镍晶体,所以操作a为:过滤、洗涤,干燥。

 初中暑期衔接系列答案
初中暑期衔接系列答案