��Ŀ����
����Ŀ����֪��Ӧ: 2SO3(g) ![]() 2SO2(g)+O2(g) ��H>0��ij�¶� �£���2molSO3����10L�ܱ������У���Ӧ��ƽ���SO3��ƽ��ת����(a)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
2SO2(g)+O2(g) ��H>0��ij�¶� �£���2molSO3����10L�ܱ������У���Ӧ��ƽ���SO3��ƽ��ת����(a)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����

����ͼ���ƶϣ�B��SO2��ƽ��Ũ��Ϊ03mol/L
����ͼ���ƶϣ�A���Ӧ�¶��µ�ƽ�ⳣ��Ϊ1.25��10-3
�۴�ƽ���ѹ�������ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
����ͬѹǿ����ͬ�¶���SO3��ת�������¶ȹ�ϵ���ͼ��ʾ
A. �٢� B. �ڢ� C. �ۢ� D. �٢�
���𰸡�B
������������������ʼŨ��Ϊ![]() =0.2mol/L���ɼ�ͼ��֪B��SO3��ת����Ϊ0.15������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ����ԡ�c��SO2��=��c��SO3��=0.15��0.2mol/L=0.03mol/L���ʶ��������ƽ��Ũ��Ϊ0.03mol/L���ٴ���A��ʱ��SO3��ת����Ϊ0.20����c��SO3��=0.20��0.2mol/L=0.04mol/L��ƽ��ʱ��SO3��SO2��O2��Ũ�ȷֱ�Ϊ0.16 mol/L��0.04mol/L��0.02mol/L��K=
=0.2mol/L���ɼ�ͼ��֪B��SO3��ת����Ϊ0.15������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ����ԡ�c��SO2��=��c��SO3��=0.15��0.2mol/L=0.03mol/L���ʶ��������ƽ��Ũ��Ϊ0.03mol/L���ٴ���A��ʱ��SO3��ת����Ϊ0.20����c��SO3��=0.20��0.2mol/L=0.04mol/L��ƽ��ʱ��SO3��SO2��O2��Ũ�ȷֱ�Ϊ0.16 mol/L��0.04mol/L��0.02mol/L��K=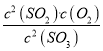 =1.25��10-3������ȷ����˷�ӦΪ�����巴Ӧ��ѹ��������൱������ѹǿ��ƽ�������������С�ķ����ƶ����������ƶ����������С�������ʵ�Ũ�����ʻ�ѧ��Ӧ���ʼӿ죬����ȷ�������¶�ƽ�������ȵķ����ƶ����������ƶ���SO3��ת���ʽ�������ͼ�� (ͼ���ϸ����ȹ���ƽ��ԭ��T1����T2�������¶ȣ�SO3��ת���ʼ�С) �����ϣ��ܴ���������������ѡ��B��
=1.25��10-3������ȷ����˷�ӦΪ�����巴Ӧ��ѹ��������൱������ѹǿ��ƽ�������������С�ķ����ƶ����������ƶ����������С�������ʵ�Ũ�����ʻ�ѧ��Ӧ���ʼӿ죬����ȷ�������¶�ƽ�������ȵķ����ƶ����������ƶ���SO3��ת���ʽ�������ͼ�� (ͼ���ϸ����ȹ���ƽ��ԭ��T1����T2�������¶ȣ�SO3��ת���ʼ�С) �����ϣ��ܴ���������������ѡ��B��

����Ŀ����֪���������壨NiC2O42H2O��������ˮ����ҵ�ϴӷ�����������Ҫ�ɷ���Ni������һ������Al2O3��Fe��SiO2��CaO�ȣ��Ʊ������������������ͼ��ʾ��
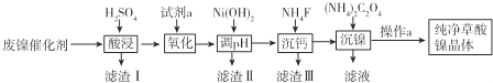
��֪������ؽ������������������������pH�����
�������� | Fe3+ | Fe2+ | Al3+ | Ni2+ |
��ʼ������pH | 1.1 | 5.8 | 3.0 | 6.8 |
��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.5 |
��Ksp(CaF2)=1.46��10-10
����ij����Ũ��С��1.0��10-5mol��L-1ʱ����Ϊ��ȫ������
��ش��������⣺
��1����д��һ�����������������ʵĴ�ʩ��______________________________________��
��2���Լ�a��һ����ɫ��������д������ʱ��Ӧ�����ӷ���ʽ��__________________________________��
��3������pH�ķ�ΧΪ________�����û�ѧ��Ӧԭ�������֪ʶ���������������ɣ�_____________��
��4��д������ʱ��Ӧ�����ӷ���ʽ��________________________________________________��֤��Ni2+�Ѿ�������ȫ��ʵ�鲽�輰������_____________________________________����Ca2+������ȫʱ����Һ��c��F-��>________mol��L-1��
��5������a��������_____________________________________________________________��