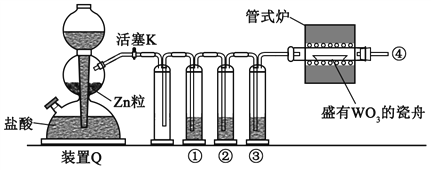
题目内容
【题目】B、N、F、Ga、As是新一代太阳能电池、半导体材料中含有的主要元素。回答下列问题:
(1)基态Ga原子的核外电子排布式是__________,基态Ga原子核外电子占据最高能级的电子云轮廓图为________。
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为__________。
(3)NF3的立体构型为_______。N2F2分子中各原子都满足8电子结构,分子中σ键和π键的个数比为______,氮原子的杂化轨道类型为__________。
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因______。
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为__________。
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为![]() ,_______。
,_______。
②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加德罗常数的值,晶体的密度为___________g/cm3(填写表达式)。
【答案】1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1 哑铃形 V、Co 三角锥形 3:1 sp2 硼单质是原子晶体,熔点高,Al、Ga均为金属晶体,且位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高 NF4+、BF4- (![]() )
) 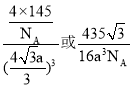
【解析】
(1)Ga是31号元素,基态Ga原子核外有31个电子,其核外电子排布式为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,由此可知,基态Ga原子核外电子占据最高能级轨道为4p轨道,p轨道为哑铃形,故答案为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;哑铃形;
(2)As的核外电子排布式为:1s22s22p63s23p63d104s24p3,基态As原子核外未成对电子数目为3,第四周期中,除As外,核外未成对电子数目为3的还有核外电子排布式子为:1s22s22p63s23p63d34s2的V,1s22s22p63s23p63d74s2的Co,故答案为:V;Co;
(3)NF3的中心原子N,σ键数=3,孤电子对数=![]() =1,价层电子对数=3+1=4,则NF3的中心原子N轨道杂化类型为sp3杂化,且有1对孤电子,则NF3的立体构型为三角锥形。N2F2分子中各原子都满足8电子结构,则N2F2的结构式为F-N=N-F,1个N2F2分子中含3个σ键,1个π键,σ键和π键的个数比=3:1,N2F2分子N原子的σ键数=3,孤电子数=0,则N原子以sp2方式杂化,故答案为:三角锥形;3:1;sp2;
=1,价层电子对数=3+1=4,则NF3的中心原子N轨道杂化类型为sp3杂化,且有1对孤电子,则NF3的立体构型为三角锥形。N2F2分子中各原子都满足8电子结构,则N2F2的结构式为F-N=N-F,1个N2F2分子中含3个σ键,1个π键,σ键和π键的个数比=3:1,N2F2分子N原子的σ键数=3,孤电子数=0,则N原子以sp2方式杂化,故答案为:三角锥形;3:1;sp2;
(4)硼单质是原子晶体,Al、Ga均为金属晶体,故B单质的熔点高于Al、Ga,Al、Ga位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高,故答案为:硼单质是原子晶体,熔点高,Al、Ga均为金属晶体,且位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高;
(5)由B、N、F元素组成的离子化合物A中,B、N、F原子的个数比为1︰1︰8,其阴阳离子是等电子体,则每个等电子体的电子数为电子总数的的一半,即为![]() =42,可将氟原子平均分配后分别和N、B组成离子,即阳离子为NF4+,阴离子为BF4-,故答案为:NF4+、BF4-;
=42,可将氟原子平均分配后分别和N、B组成离子,即阳离子为NF4+,阴离子为BF4-,故答案为:NF4+、BF4-;
(6)①从左往右4个As原子的坐标依次为:![]() ,故答案为:
,故答案为:![]() ;
;
②根据均摊法可知,1个晶胞中Ga的个数=![]() =4,As的个数=4,即1个晶胞中含4个Ga、4个As,则1个晶胞的质量m=
=4,As的个数=4,即1个晶胞中含4个Ga、4个As,则1个晶胞的质量m=![]() =
=![]() 。设晶胞边长为x,则体对角线长度为
。设晶胞边长为x,则体对角线长度为![]() =
=![]() ,则4a=
,则4a=![]() ,
,![]() ,所以1个晶胞的体积V=
,所以1个晶胞的体积V=![]() cm3,所以晶体的密度ρ=
cm3,所以晶体的密度ρ=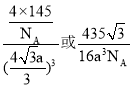 。
。