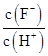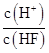题目内容
(1)将等质量的Zn粉分别投入:a:10 mL 0.1 mol·L-1 HCl和
b:10 mL 0.1 mol·L-1醋酸中。(填“>”、“=”或“<”)
①若Zn不足量,则反应速率a b,
②若Zn过量,产生H2的量a b。
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸b:醋酸中
①若Zn不足量,则起始反应速率a b,
②若Zn过量,产生H2的量a b。
b:10 mL 0.1 mol·L-1醋酸中。(填“>”、“=”或“<”)
①若Zn不足量,则反应速率a b,
②若Zn过量,产生H2的量a b。
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸b:醋酸中
①若Zn不足量,则起始反应速率a b,
②若Zn过量,产生H2的量a b。
(1)①> ②= (2)①= ②<
(1)①因为盐酸是强酸,而醋酸是弱酸,等浓度的盐酸的c(H+)远远大于醋酸的c(H+),故盐酸反应速率较大;②虽然一强一弱,但最终电离出的n(H+)相同,故产生的H2的量相同;(2)pH相同意味着c(H+)相同,故起始反应速率相同;盐酸和醋酸,由于一强一弱,醋酸的浓度要远远大于盐酸的浓度,在相同体积的情况下,醋酸的物质的量远远大于盐酸,故产生H2的量醋酸大于盐酸。

练习册系列答案
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
 A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )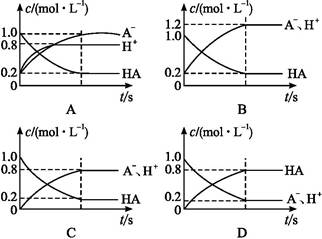
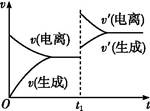
 CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )