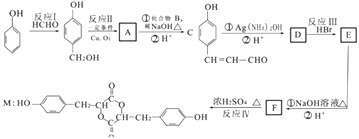
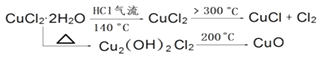题目内容
【题目】已知:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度.
【答案】
(1)17.4g
(2)0.4mol
(3)9mol/L
【解析】解:氯气的物质的量为 ![]() =0.2mol,
=0.2mol,
设耗用二氧化锰xmol,参加反应的盐酸ymol,则
MnO2+ | 4HCl(浓) | Cl2↑+2H2O |
1 | 4 | 1 |
x | y | 0.2mol |
![]() 、
、 ![]() ,
,
解得x=0.2mol,y=0.8mol,(1)反应耗用MnO2的质量为0.2mol×87g/mol=17.4g,
答:反应耗用MnO2的质量为17.4g;
(2)被氧化的HCl物质的量为0.8mol× ![]() =0.4mol,
=0.4mol,
答:被氧化的HCl物质的量为0.4mol;(3)原溶液中HCl的物质的量为0.8mol+0.1L×1mol/L=0.9mol,
原浓盐酸的物质的量浓度为c(HCl)= ![]() =9mol/L,
=9mol/L,
答:原浓盐酸的物质的量浓度为9mol/L.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目