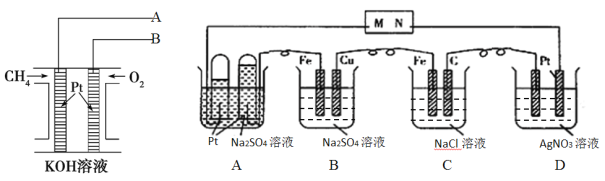
题目内容
【题目】NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(1)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:
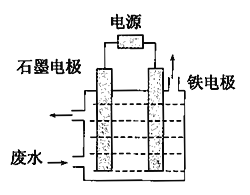
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_____________(填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为___________________________________。
(2)可用以下方法测定处理后的废水中NaCN的含量。已知:Ⅰ.废水中NaCN 的最高排放标准为0.50mg/L;Ⅱ.Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用_________________(填仪器名称)盛装;滴定终点时的现象是____________________________。
②处理后的含NaCN 的废水是否达到排放标准____________(填“是”或“否”)。
【答案】阴极 Cl-- 2e +2OH =ClO-+H2O 5ClO-+2CN-+2OH=N2↑+2CO32-+5Cl-+H2O 酸式滴定管 滴入最后一滴硝酸银溶液,产生黄色沉淀,且半分钟内沉淀不消失 否
【解析】
(1)铁电极为活性电极,若铁为阳极,则阳极为Fe-2e-=Fe2+,而不是Cl-转化为ClO-,阳极产生的ClO-的电极反应为Cl-失电子转化为 ClO-。
(2)①AgNO3溶液显酸性,会腐蚀橡皮管;滴定终点时,生成AgI。
②处理后的含NaCN 的废水是否达标排放,可利用方程式Ag++CN-=AgCN进行计算,然后与0.50mg/L进行比较。
(1)铁电极为活性电极,若铁为阳极,则阳极为Fe-2e-=Fe2+,而不是Cl-转化为ClO-,所以铁电极为阴极;阳极产生的ClO-应来自Cl-失电子,电极反应为Cl-- 2e +2OH =ClO-+H2O,阳极产生的ClO-将CN-氧化为无害物质而除去,则生成N2、CO32-等,离子方程式为5ClO-+2CN-+2OH=N2↑+2CO32-+5Cl-+H2O。
答案为:阴极;Cl-- 2e +2OH =ClO-+H2O;5ClO-+2CN-+2OH=N2↑+2CO32-+5Cl-+H2O;
(2)①AgNO3溶液显酸性,会腐蚀橡皮管,应用酸式滴定管盛装;滴定终点时的现象是滴入最后一滴硝酸银溶液,产生黄色沉淀,且半分钟内沉淀不消失。答案为:酸式滴定管;滴入最后一滴硝酸银溶液,产生黄色沉淀,且半分钟内沉淀不消失;
②n(Ag+)=1.00×10-4mol/L×0.015L=1.5×10-6mol,由方程式Ag++CN-=AgCN,可求出
n(CN-)=1.5×10-6mol,处理后的废水中NaCN 含量为![]() =3.675mg/L>0.50mg/L,所以废水没有达到排放标准。答案为:否。
=3.675mg/L>0.50mg/L,所以废水没有达到排放标准。答案为:否。

【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | I-、Cl-、H+、SO42- | NaNO3 | 6I-+2NO3-+8H+=2NO↑+4H2O+3I2 |
B | CO32-、Fe3+、Br-、SO42- | KSCN | 3SCN-+Fe3+ |
C | HClO、Na+、K+、SO32- | CaCl2 | Ca2++ SO32-=CaSO3↓ |
D | K+、Na+、HCO3-、AlO2- | HCl | H++AlO2-+H2O=Al(OH)3↓ |
A.AB.BC.CD.D
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1