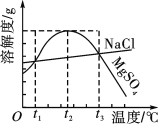
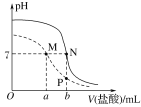
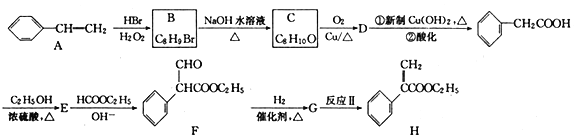
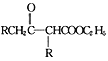题目内容
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:

①中涉及的主要反应有:
主反应:![]()

副反应: 、
、
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:
![]() “①”
“①”
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
【答案】使反应物接触更充分,加快反应速率 除去溶液中的![]() 、
、![]()
![]()
![]()
![]() 当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色 ![]()
【解析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧、主反应:![]() ,副反应:
,副反应:![]() 、
、![]() ,水浸之后除去生成的氧化铁,调节pH至4.7,除去溶液中的AlO2、SiO32,经酸化、蒸发结晶后后可生成重铬酸钠;
,水浸之后除去生成的氧化铁,调节pH至4.7,除去溶液中的AlO2、SiO32,经酸化、蒸发结晶后后可生成重铬酸钠;
(1)固体反应物在搅拌时可充分接触而反应;
(2)氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁,副反应中生成Na2SiO3、NaAlO2等杂质;
(3)CrO42转化为Cr2O72,CrO42在酸性条件下与H+离子反应生成Cr2O72;
(4)①溶液中有碘,加入淀粉溶液呈蓝色;
②根据反应的关系式计算。
(1)固体反应物在搅拌时可充分接触而反应,故答案为:使反应物接触更充分,加快反应速率;
(2)氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁,副反应中生成![]() 、
、![]() 等杂质,调节pH至
等杂质,调节pH至![]() ,可生成
,可生成![]() 、
、![]() 沉淀过滤除去,故答案为:除去溶液中的
沉淀过滤除去,故答案为:除去溶液中的![]() 、
、![]() ;(3)
;(3)![]() 转化为
转化为![]() ,
,![]() 在酸性条件下与
在酸性条件下与![]() 离子反应生成
离子反应生成![]() ,该反应为可逆反应,反应的离子方程式为
,该反应为可逆反应,反应的离子方程式为![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
(4)①溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②根据反应的关系式计算:

![]() ,则
,则![]() 重铬酸钠试样中含有的重铬酸钠晶体的质量为
重铬酸钠试样中含有的重铬酸钠晶体的质量为![]() ,
,
所得产品的中重铬酸钠晶体的纯度![]() ,
,
故答案为:![]() .
.

【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
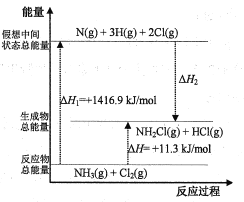
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
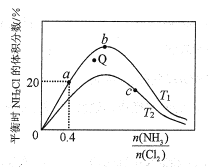
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。