题目内容
【题目】C和Si元素在化学中占有极其重要的地位:
(1)写出Si的基态原子核外电子排布式 . 从电负性角度分析,C,Si和O元素的非金属活泼性由强至弱的顺序为 .
(2)CO2分子的空间构型为 , 中心原子的杂化方式为 , 和CO2 互为等电子体的氧化物是 .
(3)C,Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键.
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 , 在SiC中,每个C原子周围最近的C原子数目为 , 若晶胞的边长为a pm,则金刚砂的密度为 . 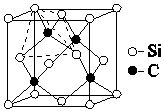
【答案】
(1)1s22s22p63s23p2;O>C>Si
(2)直线形;sp;N2O
(3)Si原子比C原子半径大,Si、O原子间距离较大,P﹣P轨道肩并肩重叠程度较小,不能形成上述稳定的π键
(4)原子晶体;12;![]()
【解析】解:(1)Si是14号元素,Si原子核外共14个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道;其电子排布式为:1s22s22p63s23p2;从电负性的角度分析,O和C位于同一周期,非金属性O强于C;C和Si为与同一主族,C的非金属性强于Si,故由强到弱为O>C>Si, 所以答案是:1s22s22p63s23p2; O>C>Si;(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体,和CO2 互为等电子体的氧化物是N2O,
所以答案是:直线形;sp;N2O;(3)CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键,是因Si原子比C原子半径大,Si、O原子间距离较大,P﹣P轨道肩并肩重叠程度较小,不能形成上述稳定的π键,所以答案是:Si原子比C原子半径大,Si、O原子间距离较大,P﹣P轨道肩并肩重叠程度较小,不能形成上述稳定的π键;(4)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12;该晶胞中C原子个数=8× ![]() +6×
+6× ![]() =4,Si原子个数为4,晶胞边长=a×10﹣10cm,体积V=(a×10﹣10cm)3 , ρ=
=4,Si原子个数为4,晶胞边长=a×10﹣10cm,体积V=(a×10﹣10cm)3 , ρ= ![]() =
= 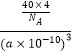 gcm3=
gcm3= ![]() gcm3;
gcm3;
所以答案是:原子晶体;12; ![]() .
.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下列物质的分类正确的是( )
单质 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 | |
A | H2 | 干冰 | CuO | H2SO4 | 纯碱 | 熟石灰 |
B | 碘酒 | SO2 | Na2O | HCl | NH3·H2O | NaCl |
C | 液氯 | CO | Fe2O3 | CH3COOH | CH3CH2OH | 绿矾 |
D | HD | P2O5 | 生石灰 | HNO3 | KOH | CaCO3 |
A. A B. B C. C D. D
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称是______,碱性最强的化合物的化学式是_______。
(2)⑤⑦形成化合物的电子式___。②形成的最高价氧化物的结构式____。
(3)最高价氧化物是两性氧化物的元素其元素符号是____;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式________。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________。